
- UPSC IAS 预备考试化学笔记(第一部分)
- 化学 - 首页
- 我们周围的物质
- 我们周围的物质是纯净的吗
- 化学 - 原子与分子
- 化学 - 原子的结构
- 化学反应与方程式
- 化学 - 酸、碱和盐
- 材料:金属和非金属 I
- 化学 - 金属与非金属 II
- 碳及其化合物
- 元素的周期性分类
- 合成纤维和塑料
- 化学 - 煤和石油
- 化学 - 燃烧和火焰
化学第一部分 - 快速指南
化学 - 我们周围的物质
引言
宇宙中的一切都由某些物质构成,科学家称之为“物质”。例如,我们吃的食物、我们呼吸的空气、石头、云、星星、植物、动物、水、灰尘,所有的一切都被归类为物质。
物质微粒的特性
物质微粒非常小,通常肉眼无法看到。
物质微粒不断运动,这被称为“动能”。
微粒的动能直接取决于温度,温度升高,运动速度也随之升高。
物质微粒之间存在吸引力;因此,它们相互吸引。
微粒的吸引力将微粒结合在一起;然而,吸引力的强度因物质种类而异。
物质的状态
物质有以下三种状态:
固态
液态
气态
让我们简要讨论一下:
固态
所有固体物质都具有确定的形状、明显的边界和固定的体积。
大多数固体物质的可压缩性可以忽略不计。
所有固体物质在受到外力作用时都具有保持其形状的自然倾向。
固体物质可以在外力作用下断裂,但很难改变其形状,因为它们是刚性的。
液态
与固体不同,液体没有固定的形状;然而,它们具有固定的体积。
液体占据其所盛容器的形状。
液体具有流动和改变形状的特性。
气态
空气形式的物质,既不是固体也不是液体,被称为气体。例如,氧气、氮气、氢气等。
与固体不同,气体没有确定的体积和形状。
诸如液化石油气(LPG——用于烹饪);压缩天然气(CNG——用作车辆燃料)等气体具有高可压缩性;因此,大量的燃气可以压缩到一个小的气瓶中,并可以方便地运输。
气体通常表现出非常快速地扩散到其他气体中的特性。这就是我们能够闻到(好闻或难闻)远处气味的原因。
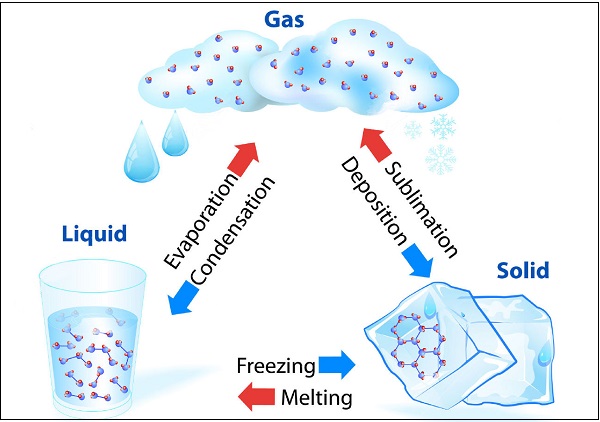
物质可以改变其状态
水可以存在于三种状态,例如冰为固态;水(H2O)为液态;水蒸气为气态。下图说明了水在不同状态下的转化:
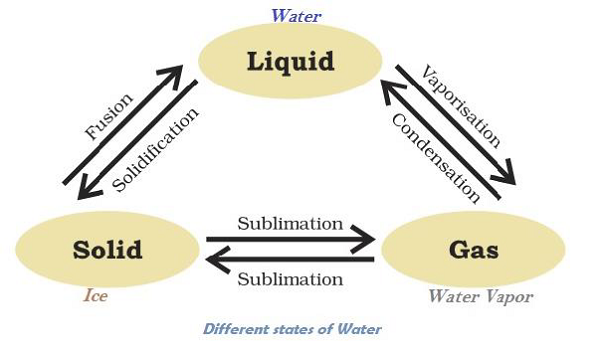
在给定大气压下,固体熔化并转变为液体的温度称为“熔点”。
固体的熔点表明其微粒之间吸引力强度的指标。
冰的熔点为 273.16 K,即 00 C。
熔化过程(即固态转变为液态)称为熔化。
在给定大气压下,将 1 kg 固体材料转变为液体材料所需的热能称为熔化潜热。
在给定大气压下,液体开始沸腾的温度称为“沸点”。
水的沸点为 373 K,即 1000C。
物质直接从固态转变为气态而不转变为液态(或反之)的状态变化称为“升华”。
在低于其沸点的任何温度下,液体转变为蒸汽的现象称为“蒸发”。
固体二氧化碳 (CO2) 在高压下储存。

一旦压力降低到 1 个大气压,固体 CO2 会直接转化为气态。
大气压 (atm) 是测量气体施加压力的单位,压力的单位是帕斯卡 (Pa);1 个大气压 = 1.01 × 105 Pa。
物质的第四态
等离子体是一种由超高能和超激发粒子组成的状态。

超激发粒子以电离气体的形式存在。例如,荧光管(含有氦气)和霓虹灯(含有氖气)包含等离子体。
化学 - 我们周围的物质是纯净的吗
引言
纯净物是由单一类型或类型的粒子组成的物质。

两种或多种纯组分混合物,不含任何不需要的物质,被称为混合物,例如水、矿物、土壤等。
两种或多种物质的均匀混合物被称为溶液。例如,柠檬水、苏打水等。
溶液可以是任何形式,例如液体、固体或气体。
合金是混合物的另一个例子,它含有金属的均匀混合物;它们不能通过物理方法分离成其组分。例如,黄铜是锌(约 30%)和铜(约 70%)的混合物。
溶液的显著特征
溶液通常是均匀混合物。
溶液的粒子直径甚至小于 1 nm(10-9 米),因此肉眼无法看到。
在溶液中,光的路径不可见。
溶解的粒子不能通过简单的过滤过程从混合物中分离出来。
溶解的粒子在静置时不会沉淀。
在给定温度下,当不再有溶质溶解在溶液中时,它被称为“饱和溶液”。
在给定温度下,饱和溶液中存在的溶解粒子的量称为“溶解度”。
悬浊液
悬浮液是一种非均匀混合物,其中溶质粒子不溶解,而是悬浮在介质的大部分中,被称为“悬浮液”。
悬浮液的显著特征
悬浮液的粒子肉眼可见。

悬浮液的粒子散射通过它的光束,并且它的路径也是可见的。
溶质粒子可以通过简单的过滤过程从混合物中分离出来。
胶体
非均匀混合物被称为“胶体”。例如,雾、烟雾、烟、面霜等。

胶体粒子的尺寸太小,肉眼无法看到。
胶体粒子足够大,可以散射通过它的光束,并使路径可见。
胶体粒子不能通过简单的过滤过程从混合物中分离出来。
特殊的过滤技术,即离心,可用于分离胶体粒子。
色谱法
分离混合物组分的过程称为色谱法;通常用于颜色分离。
色谱技术用于分离溶解在相同溶剂中的溶质。
蒸馏
通过加热和冷却的方法提纯液体的过程称为蒸馏。
结晶
以晶体形式从溶液中分离纯固体的过程称为“结晶”。
元素
1661 年,罗伯特·博伊尔是第一个使用元素一词的科学家;法国化学家安托万·洛朗·拉瓦锡是第一个通过实验定义元素一词的人。
元素是物质的基本形式,不能通过化学反应分解成更简单的物质。
元素通常可以分为金属、非金属和准金属。
金属
一种固体材料,通常坚硬、延展性好、可锻造、有光泽、易熔,具有良好的导电性和导热性,被称为金属。例如,金、银、铜、铝等。

汞是唯一在室温下保持液态的金属。
非金属
所有不是金属的元素或物质都称为非金属。例如,氢气、氧气、碘、碳等。
非金属具有多种颜色,并且是热和电的不良导体。
非金属不具有光泽、声响或延展性。
化合物
由两种或多种元素组成的物质称为“化合物”。
化合物是由两种或多种元素以固定比例化学结合的结果。
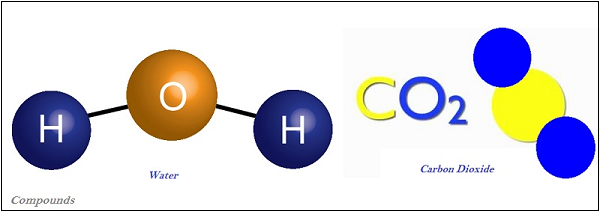
化合物的性质与其组成元素有所不同,而混合物的性质与其组成元素或化合物相同。
化学 - 原子与分子
引言
大约公元前 500 年,印度哲学家摩里什·卡纳德首次提出了物质不可分割部分的概念,并将其命名为“pramanu”。
1808 年,约翰·道尔顿使用了“原子”一词,并将原子理论应用于物质的研究。

道尔顿原子理论
根据道尔顿原子理论,所有物质,无论是元素、化合物还是混合物,都由称为原子的微小粒子组成。
根据道尔顿原子理论,所有物质,无论是元素、化合物还是混合物,都由称为原子的微小粒子组成。
道尔顿原子理论的显著特征
所有物质都是由称为原子的非常微小的粒子组成的。
原子是不可分割的粒子,不能通过化学反应产生或破坏。
一种元素的所有原子在质量和化学性质上是相同的,而不同元素的原子具有不同的质量和化学性质。
原子以简单的整数比结合形成化合物。
在给定的化合物中,原子的种类和相对数量是恒定的。
原子质量
一个化学元素原子的质量;以原子质量单位 (符号为u) 表示。
原子质量大致等于原子中质子和中子的数量。
一个原子质量单位等于碳-12原子质量的十二分之一 (1/12),所有元素的相对原子质量都是相对于碳-12原子计算的。
分子
元素或化合物的最小粒子,能够独立存在并表现出相应物质的所有特性。
分子通常是由两个或多个以化学键结合在一起的原子组成的。
相同元素或不同元素的原子可以(通过化学键)结合在一起形成分子。
构成分子的原子数称为其原子性。
离子
带电粒子称为离子;它可以是负电荷或正电荷。
带正电的离子称为“阳离子”。
带负电的离子称为“阴离子”。
化学式
化合物的化学式表示其组成元素以及每种结合元素的原子数。
化合物的化学式是其组成的符号表示。
元素的化合能力称为其“化合价”。
分子质量
物质的分子质量是通过将分子中所有原子的原子质量加和计算得到的。例如,水的分子质量计算如下:
氢的原子质量 = 1u
氧的原子质量 = 16 u
水分子含有两个氢原子和一个氧原子。
水的分子质量 = 2 × 1 + 1 × 16 = 18 u (u是分子质量的符号)。
式量
物质的式量是通过将化合物一个式量单位中所有原子的原子质量加和计算得到的。
阿伏加德罗常数或阿伏加德罗数
阿伏加德罗是一位意大利科学家,他提出了阿伏加德罗数(也称为阿伏加德罗常数)的概念。
1摩尔任何物质中存在的粒子(原子、分子或离子)的数量是固定的,其值始终计算为6.022 × 1023。
1896年,威廉·奥斯特瓦尔德提出了“摩尔”的概念;然而,摩尔单位直到1967年才被接受,为报告大量提供了一种简单的方法。
质量守恒定律
在化学反应过程中,反应物和产物的质量总和保持不变,这被称为“质量守恒定律”。
定比定律
在纯净的化合物中,其各元素的质量比总是恒定的,这被称为“定比定律”。
化学 - 原子的结构
引言
到1900年,人们发现原子不是简单的、不可分割的粒子,而是包含亚原子粒子的。
J.J.汤姆孙发现了亚原子粒子“电子”。

J.J.汤姆孙是第一个提出原子结构模型的人。
1886年,E.戈德斯坦在气体放电中发现了新的辐射,并将其命名为阴极射线。
通过阴极射线的实验,又发现了一种带正电的亚原子粒子,并将其命名为质子。
汤姆孙原子模型
汤姆孙提出,原子由一个带正电的球体构成,电子(负电荷)嵌在其中(如下图所示)。
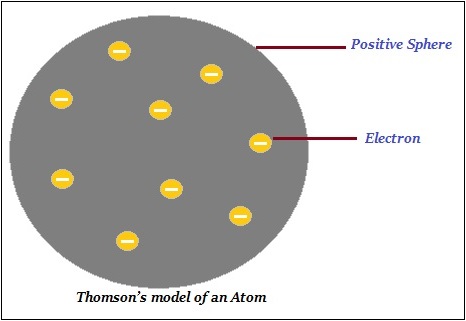
此外,汤姆孙说负电荷和正电荷在数量上相等。因此,原子整体上是电中性的。
卢瑟福原子模型
E.卢瑟福被称为核物理学的“奠基人”。

卢瑟福因其在放射性和发现原子原子核方面的研究而闻名,这通过金箔实验得以证实(如下图所示)。
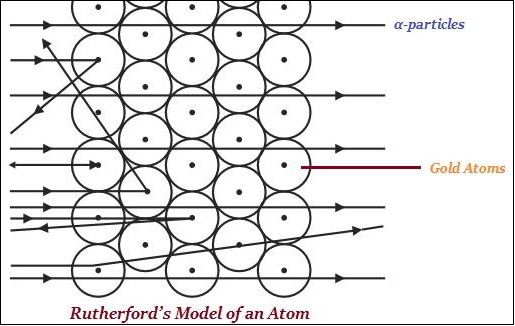
卢瑟福说,在原子中,存在一个带正电的中心,称为原子核。
卢瑟福说,几乎所有原子的质量都存在于原子核中。
根据卢瑟福的理论,电子在明确定义的轨道上围绕原子核旋转。
玻尔原子模型
尼尔斯·玻尔进一步扩展了卢瑟福的模型并改进了其缺点。

根据玻尔的理论,原子内部只允许存在某些特殊的轨道,称为电子的分立轨道。
玻尔说,电子在分立轨道上旋转时不会辐射能量。
玻尔将轨道或壳层称为能级(如下图所示)。
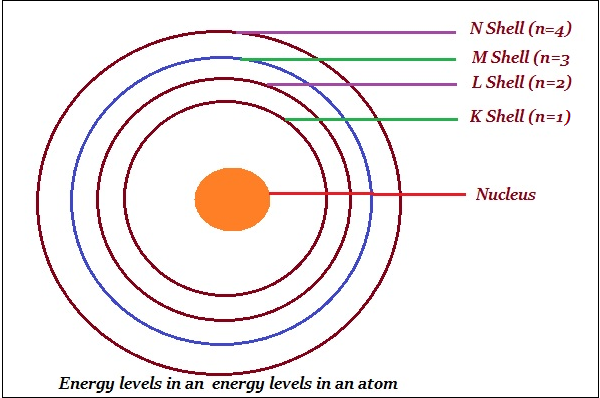
玻尔用字母 K、L、M、N……或数字 n = 1、2、3、4……表示这些轨道或壳层。
中子
1932年,J.查德威克发现了一种新的亚原子粒子,即中子。
中子不带电,质量几乎等于质子。
除了氢原子外,所有原子的原子核中都存在中子。
电子在不同轨道(壳层)中的分布
一个壳层中最多可以容纳的电子数由公式2n2给出。
'n'是轨道数或能级指标,即 1、2、3……
根据上述公式:
第一轨道,即K壳层,将是 = 2 × 12 = 2
第二轨道,即L壳层,将是 = 2 × 22 = 8
第三轨道,即M壳层,将是 = 2 × 32 = 18
第四轨道,即N壳层,将是 = 2 × 42 = 32
同样,最外层轨道最多可以容纳8个电子。
除非内层壳层已充满,否则电子不会填充到给定的壳层中。这意味着壳层是逐步填充的;从内层壳层到外层壳层。
价电子
存在于原子最外层壳层的电子称为价电子。
根据玻尔-布里模型,原子的最外层壳层最多可以有8个电子。
原子序数
原子核中质子的总数称为原子序数。
原子的质子数决定了原子序数。
原子序数用'Z'表示。
质子和中子统称为核子。
质量数
原子核中质子和中子总数之和称为质量数。
同位素
具有相同原子序数但质量数不同的相同元素的原子称为同位素。例如,氢原子有三种同位素:氕、氘和氚。
原子的同位素的化学性质相似,但物理性质不同。
同量异位素
具有不同原子序数但质量数相同的不同元素的原子称为同量异位素。例如,钙的原子序数为20,氩的原子序数为18;此外,这些原子中的电子数不同,但这两个元素的质量数均为40。
化学 - 化学反应与方程式
引言
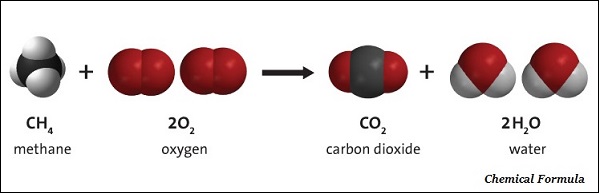
一种或多种化学物质与其他化学物质发生反应并转化为一种或多种不同物质的过程称为化学反应。
化学方程式
化学方程式是化学反应的符号表示;它通过符号和公式表示。例如:
镁 + 氧气 = 氧化镁
Mg + O2 = MgO
镁和氧气被称为反应物,反应的结果,即氧化镁,被称为产物。
记住,化学反应产物中存在的元素的总质量必须等于反应物中存在的元素的总质量。
每种元素的原子数在化学反应前后始终保持相同。
化学反应类型
以下是主要的化学反应类型:
化合反应
分解反应
置换反应
让我们简要讨论一下每个反应:
化合反应
当两种或多种物质(即元素或化合物)反应形成单一产物时,这种反应称为化合反应。例如:
CaO(s) +H2O(l)→Ca(OH)2(aq)
(生石灰) (熟石灰)
如上述反应所示,氧化钙和水反应(或结合)形成单一产物,称为氢氧化钙。
除了产物的形成外,还会释放热量的化学反应称为放热化学反应。
分解反应
单一反应物分解成更简单的产物的反应称为分解反应。例如:

在上述反应中,硫酸亚铁晶体(即 FeSO4·7H2O)加热时会失去水,晶体的颜色也会发生变化。最终,它会分解成氧化铁 (Fe2O3)、二氧化硫 (SO2) 和三氧化硫 (SO3)。
置换反应
一种元素取代或去除另一种元素的反应称为置换反应。例如:
Fe(s)+ CuSO4(aq)→FeSO4(aq)+Cu(s)
(硫酸铜)(硫酸亚铁)
在上例反应中,铁从硫酸铜溶液中置换出铜,形成硫酸亚铁。
氧化和还原
如果物质在反应过程中获得氧气,则称为氧化。另一方面,如果物质在反应过程中失去氧气,则称为还原。例如:
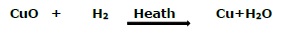
在上述反应中,氧化铜失去氧气,因此被还原(即还原);另一方面,氢气获得氧气,因此被氧化(即氧化)。
腐蚀
当金属受到周围环境中存在的物质(如水分、酸等)的侵蚀时,则称为腐蚀。例如,银上的黑色涂层、铜上的绿色涂层等。

酸败
脂肪和油被氧化,这个过程称为酸败。它们的气味、味道、颜色等也会发生变化;同样,它使食物不适宜食用。
化学 - 酸、碱和盐
引言
食物尝起来酸和苦,这仅仅是因为分别存在酸和碱。
石蕊溶液
从地衣中提取的石蕊呈紫色(见下图),但条件是当它既不是酸性也不是碱性,即中性时。

石蕊基本上是一种属于藻类植物的植物,在化学实验中,它通常用作指示剂。
在酸性或碱性介质中气味发生变化的物质称为嗅觉指示剂。
水溶液中的酸或碱
HCl 中的氢离子是由于水的存在而产生的。其次,在没有水的情况下,无法从 HCl 分子中分离出 H+ 离子。化学式如下所示
HCl + H2O → H3O+ + Cl–
此外,氢离子不能单独存在,但它们可以在水分子存在下存在。因此,氢离子表示为 H+(aq) 或水合氢离子 (H3O+)。化学式为:
H+ + H2O → H3O+
可溶于水的碱称为碱。但并非所有碱都溶于水。
如果将水加入浓酸中,会产生热量。
将酸或碱与水混合会导致单位体积内离子(即H3O+/OH–)浓度降低,此过程称为稀释。
pH值
用于测量溶液中氢离子浓度的标度称为pH值标度。
pH中的‘p’代表‘potenz’,这是一个德语单词,意思是‘power’(幂)。
pH值只是一个数字,表示溶液的酸性或碱性。因此,如果水合氢离子浓度越高,则pH值越低。
pH值的范围在‘0’和‘14’之间;因此,如果测得pH值为‘0’,则表示其为强酸性;如果为14,则表示其为强碱性。
pH值的中间值为‘7’。
在pH值标度上,小于7的值表示酸性溶液,大于7的值表示碱性溶液。
通常,使用浸渍有常用指示剂的试纸来测量pH值(见下图)−
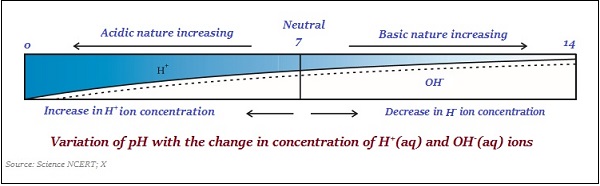
同样,酸和碱的强度主要取决于分别产生的H+离子和OH–离子的数量。
下图大致说明了一些常见物质的pH值(颜色变化)−
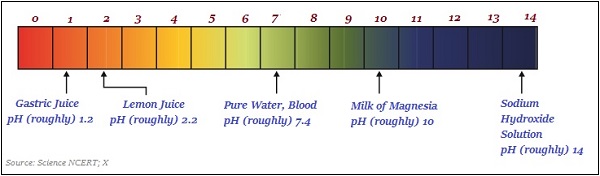
pH值在日常生活中的重要性
人体pH值的范围在7.0到7.8之间。
人体胃部会产生盐酸,有助于食物消化;令人惊讶的是,它不会损害胃部。
然而,当胃部产生过多的酸(称为消化不良)时,会导致疼痛和刺激。为了缓解这种疼痛,医生建议使用称为抗酸剂的碱性物质。
这些抗酸剂可以中和并控制过量的酸。
牙齿由磷酸钙构成,是人体中最坚硬的物质。然而,当口腔中的pH值下降(低于5.5)时,会腐蚀牙齿。
盐通常由盐酸和氢氧化钠溶液组合而成;这种组合被称为氯化钠。
当雨水的pH值测得小于5.6时,称为酸雨。
当酸雨流入河流时,也会降低河水的pH值。
酸性河水对水生生物的生存构成威胁。
漂白粉
漂白粉是由氯作用于干燥的熟石灰[Ca(OH)2]而产生的,其化学式为CaOCl2。
漂白粉通常用于纺织工业、造纸厂、化工行业以及饮用水的消毒。
小苏打
小苏打通常用于厨房,以烹饪美味酥脆的食物。它还可以使某些食物更快地烹饪。
小苏打的化学名称是碳酸氢钠,化学式为NaHCO3。
苏打灰
碳酸钠的重结晶会产生苏打灰。
苏打灰的化学式为Na2CO3·10H2O。
苏打灰通常用于玻璃、肥皂和造纸工业。
石膏
石膏是一种白色粉末,医生用它作为骨折骨骼的固定石膏。
石膏的化学名称是半水硫酸钙,化学式为2CaSO4·H2O。
材料:金属和非金属 1
引言
金属可以根据其化学和物理性质与非金属区分开来。
金属可以被锤打成薄片,这种性质称为延展性。
金属可以被拉成细丝,这种性质称为延性。
金属通常坚硬、具有延展性、光泽、延性、具有声响性,并且是良好的导热体和导电体。例如:铁、铜、钙、铝、镁等。

不具有声响性且导热和导电性差的材料称为非金属。例如:硫、碳、氧、磷等。
一些金属,如钠和钾,质地柔软,可以用刀切割。
汞是唯一一种在室温下保持液态的金属。
二氧化硫溶于水后会形成亚硫酸。举例说明 - 二氧化硫 (SO2) + 水 (H2O) → 亚硫酸 (H2SO3)。
非金属氧化物呈酸性。
亚硫酸会使蓝色石蕊试纸变红。
磷是一种非常活泼的非金属,一旦暴露在空气中就会着火。
为了防止磷与大气中的氧气接触,磷储存在水中。
燃烧时,金属易与氧气反应生成金属氧化物,这些氧化物呈碱性。
非金属与氧气反应生成非金属氧化物;这些氧化物呈酸性。
一些金属与水反应生成金属氢氧化物和氢气。
非金属通常不与水反应。
金属也与酸反应生成氢气和金属盐。
非金属通常不与酸反应。
金属和非金属的用途
金属用于制造机械、飞机、汽车、火车、卫星、工业设备、炊具、热水器等。
非金属用于肥料,以促进植物生长。
非金属用于水净化。
非金属用于鞭炮。
化学 - 金属和非金属 2
引言
通常坚硬、可锻造、有光泽、易熔和易拉伸的固体材料称为金属。例如:铁、铜、铝、镁、钠、铅、锌等。
金属通常具有良好的导电性和导热性。

纯态的金属具有闪亮的表面,称为金属光泽。
金属可以被锤打成薄片;这种性质称为延展性。
金属可以被拉成细丝的性质称为延性。例如:金是最具有延性的金属。
银和铜是最好的导热体。
非金属
非金属通常以固体或气体状态存在。然而,溴是一个例外,它以液态存在。
一些主要的非金属例子包括碳、硫、碘、氧、氢等。

金属和非金属的事实
除汞外,所有金属在室温下都以固态存在。
镓和铯的熔点非常低;这两种金属甚至在手掌上就会熔化。
碘是一种非金属,但它具有光泽(光泽是金属的特性)。
碳是一种非金属,可以以不同的形式存在。每种形式称为同素异形体。
金刚石是碳的一种同素异形体,是已知最坚硬的天然物质。
金刚石的熔点和沸点非常高。
石墨也是碳的一种同素异形体;它是导电体。
锂、钾、钠等碱金属是软金属的例子,因为它们可以用刀切割。
几乎所有金属与氧气结合后都会形成金属氧化物。
不同的金属具有不同的反应频率;有些反应缓慢,有些反应非常快。例如:钾和钠非常活泼,只要暴露在空气中就会着火。
因此,钾和钠浸没在煤油中以防止着火。
然而,在所有金属中,钠(最有可能)是最活泼的金属。
阳极氧化是在铝上形成厚的保护性氧化层以防止腐蚀的过程。
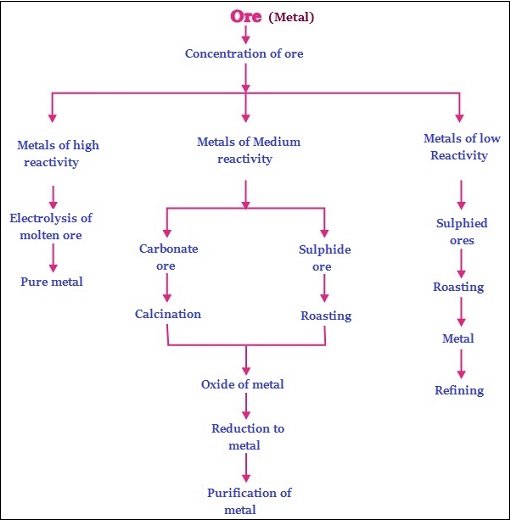
天然存在于地壳(上层)中的元素或化合物称为矿物。
未加工状态的矿物称为矿石。例如:金、银、铁等。(下图显示了铁矿石)−

从地球中提取的矿石通常含有大量的杂质,例如与某些元素、土壤、沙子等混合,称为“脉石”。
根据反应性和从矿石中提取的情况,金属可以分为−
化学 - 碳及其化合物
引言
碳对所有生物都起着非常重要的作用。
地球地壳中碳的含量仅为0.02%,以碳酸盐、碳酸氢盐、煤和石油等矿物形式存在。
地球大气中碳的含量为0.03%,以二氧化碳的形式存在。
碳的化合物
几乎所有碳化合物(少数例外)都是不良的导电体。
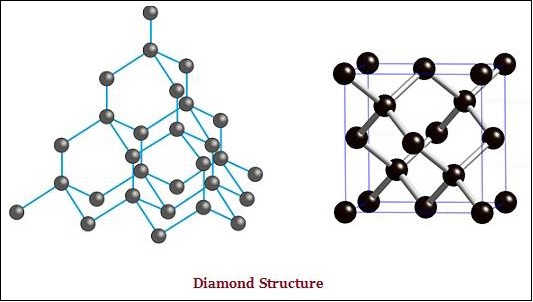
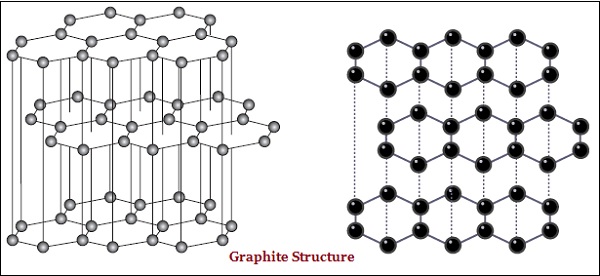
金刚石和石墨都是由碳原子形成的;然而,它们之间的区别在于碳原子相互键合的方式。
在金刚石中,每个碳原子都与其他四个碳原子键合,形成刚性的三维结构(见下图)。
在石墨中,每个碳原子都与同一平面上的另外三个碳原子键合,形成六边形阵列(见下图)−
金刚石和石墨的一些物理结构也有所不同。
金刚石是已知最坚硬的物质,而石墨则是一种光滑且易滑的物质。
石墨是良好的导电体,而金刚石则不是。
下表列出了碳氢化合物的结构−
| 名称 | 化学式 | 结构 |
|---|---|---|
| 甲烷 | CH4 | 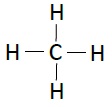 |
| 乙烷 | C2H6 | 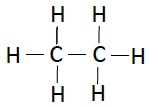 |
| 丙烷 | C3H8 | 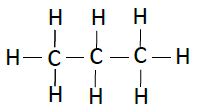 |
| 丁烷 | C4H10 | 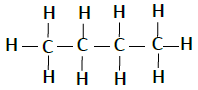 |
| 戊烷 | C5H12 | 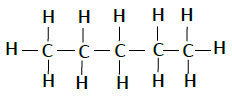 |
| 己烷 | C6H14 | 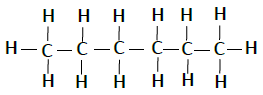 |
具有相同分子式但结构不同的化合物称为结构异构体(见下图所示的丁烷结构)。
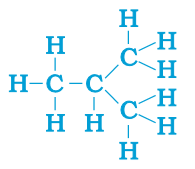
饱和烃称为烷烃。
含有一个或多个双键的不饱和烃称为烯烃。
含有一个或多个三键的不饱和烃称为炔烃。
酒精作为燃料的用途
甘蔗植物非常有效地将阳光转化为化学能,其汁液可用于制备糖蜜。
糖蜜发酵后会产生酒精(乙醇)。
一些国家现在使用酒精作为汽油的添加剂,因为它是一种更清洁的燃料。
这些酒精在充足的空气(氧气)中燃烧时,只会产生二氧化碳和水。
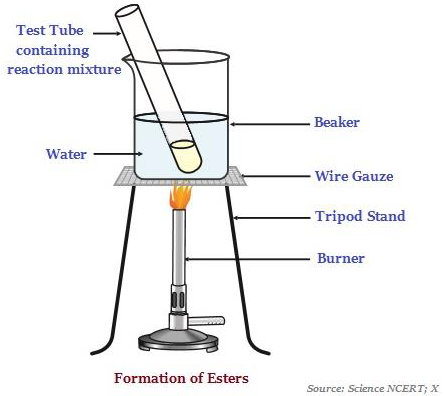
酯
酯是具有甜味的物质,最常见的是由酸和醇反应形成的(见下图 - 说明酯的形成)。
酯在酸或碱存在下反应,会重新生成醇和羧酸。
酯与酸或碱的反应称为皂化反应,因为它用于制备肥皂。
肥皂分子通常是长链羧酸的钠盐或钾盐。
有趣的是,肥皂的离子端溶于水,而碳链溶于油。肥皂分子的这种典型特征形成了被称为胶束的结构(见下图)。
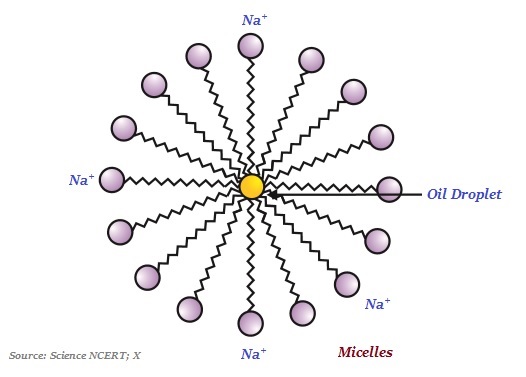
在胶束中,分子的一端朝向油滴,而离子端则留在外面。
肥皂胶束有助于溶解水中的污垢;同样,衣服也得到了清洁。
另一方面,洗涤剂通常是长链羧酸的铵盐或磺酸盐,即使在硬水中也能有效。
洗涤剂通常用于制造洗发水和其他一些清洁衣物的产品。
元素的周期性分类
引言
到今天为止,我们已经知道大约有115种元素。
根据它们的性质,所有元素都按顺序排列,称为元素周期表。
德国科学家约翰·沃尔夫冈·多贝尔纳于1817年首次尝试排列元素。
英国科学家约翰·纽兰兹也尝试排列当时已知的元素(1866年)。
约翰·纽兰兹遵循原子质量递增的顺序来排列元素。
纽兰兹从原子质量最低的元素(如氢)开始,结束于钍,当时是第56号元素。

纽兰兹的元素排列被称为“八音律”,因为在他的排列中,每八个元素的性质与第一个元素相似。例如,锂和钠的性质被发现是相同的。
| Sa (do) | re (re) | Ga (mi) | Ma (fa) | Pa (so) | da (la) | ni (ti) |
|---|---|---|---|---|---|---|
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co & Ni | Cu | Zn | Y | In | As | Se |
| Br | Rb | Sr | Ce & La | Zr |
纽兰兹还将其与音乐中发现的八度音程进行了比较(见上表)。
在印度音乐中,七个音符是—— *sa, re, ga, ma, pa, da, ni*;然而,在西方,音符是—— *do, re, mi, fa, so, la, ti*。
此外,为了将一些元素放入他的表中,纽兰兹将两个元素放在同一个单元格中(见上表——钴和镍放在同一个单元格中),但这并没有奏效,因为它们的性质不同。
然而,八音律有一定的局限性,因为它只适用于钙;钙之后,每八个元素的性质并不与第一个元素相似。
门捷列夫元素周期表
德米特里·伊万诺维奇·门捷列夫,一位俄罗斯化学家,他成功地尝试排列元素。
门捷列夫根据元素的基本性质——原子质量以及化学性质的相似性来排列元素。
在门捷列夫时代,只知道63种元素。
门捷列夫周期表由称为“族”的纵列和称为“周期”的横行组成。

门捷列夫周期律指出:
“元素的性质是其原子质量的周期函数”。
门捷列夫以倒序排列,以便将具有相似性质的元素组合在一起。
门捷列夫为当时尚未发现的一些元素留下了空间;他大胆地预测了未来元素的存在。
门捷列夫周期公式最大的局限性之一是——氢在元素周期表中没有固定的位置。
现代元素周期表
1913年,英国物理学家亨利·莫塞莱发现,元素的原子序数比其原子质量更基本。
根据莫塞莱的发现,门捷列夫周期律得到了修改,原子序数被作为现代元素周期表的基础。
现代周期律指出:
“元素的性质是其原子序数的周期函数”。
现代元素周期表定义了18列纵列,称为“族”,和7行横行,称为“周期”。
在现代元素周期表中,元素的排列方式显示了原子大小、化合价或化合能力以及元素的金属性和非金属性等性质的周期性。
在现代元素周期表中,金属性沿周期递减,沿族递增。
另一方面,非金属具有电负性,因为它们倾向于通过获得电子来形成键。
在现代元素周期表中,非金属位于右侧(从顶部)。
化学——合成纤维和塑料
引言
我们穿的衣服是由织物制成的,织物是由纤维制成的,纤维来源于天然或人工来源。
纤维的天然来源是棉花、羊毛、丝绸等,它们来自植物或动物。
合成纤维是由人类制造的;因此,这些被称为合成纤维或人造纤维。
合成纤维通常是由连接在一起的小单元组成的链;每个小单元都是一种化学物质。
合成纤维的类型
人造丝通常被称为人造丝。
人造丝(纤维)是通过对木浆进行化学处理获得的。
由煤、水和空气制成的纤维被称为尼龙。

尼龙是第一种全合成纤维。
涤纶也是一种合成纤维;它是不易起皱的纤维。例如,特丽纶。
PET是涤纶的一种常见形式,用于制造餐具、瓶子、薄膜、电线以及许多其他有用的产品。
涤纶(聚酯)是由一种称为酯的化学物质的重复单元组成的。
塑料也像合成纤维一样是一种聚合物。
聚乙烯(聚乙烯)是塑料的一个常见例子。
有些塑料,一旦成型,就不能通过加热软化;因此,这些被称为热固性塑料。例如,酚醛树脂和三聚氰胺。
酚醛树脂是热和电的不良导体;因此,它用于制造电开关、各种器皿的把手等。
三聚氰胺耐火,比其他塑料更耐热;因此,它用于制造地砖、厨房用具和织物。
通过自然过程(例如,细菌的作用)而分解的物质被称为可生物降解的。
不能轻易被自然过程分解的物质被称为不可生物降解的。
塑料不利于环境。
化学——煤和石油
引言
自然界中数量无限,不太可能因人类活动而枯竭的资源被称为取之不尽的自然资源。例如,阳光、空气。
自然界中数量有限,可能因人类活动而枯竭的资源被称为可枯竭的自然资源。例如,森林、野生动物、矿物、煤、石油、天然气等。
可枯竭的自然资源是由生物的遗骸(化石)形成的;因此,这些自然资源也称为化石燃料。例如,煤、石油和天然气。
煤
煤坚硬如石,颜色为黑色。
煤是用来做饭的燃料之一。

煤用于火力发电厂发电。
在高压和高温下,埋在地球内部的死亡植物慢慢地变成了煤。
煤主要含有碳。
死亡植被转化为煤的缓慢过程被称为碳化。
煤是由植物残骸形成的;因此,它也称为化石燃料。
煤燃烧时,主要产生二氧化碳气体。
煤在工业中加工时,会产生一些有用的产品,如焦炭、煤焦油和煤气。
焦炭是一种坚硬、多孔的黑色物质。
焦炭是纯碳。
焦炭主要用于钢铁制造和许多金属的提取。
煤焦油是一种黑色、粘稠的液体,气味难闻。
煤焦油是由大约200种物质组成的混合物。
从煤焦油中获得的产品被用作制造日常生活中和工业中使用的各种物质的起始材料。例如,炸药、油漆、屋顶材料、合成染料、药品、香水、塑料、照相材料等。
从煤焦油中获得的萘丸用于驱除飞蛾和其他昆虫。
从石油产品中获得的沥青用于代替煤焦油铺路。
在煤加工制取焦炭的过程中,会得到煤气。
1810年,英国伦敦首次使用煤气进行街道照明,1820年,美国纽约也开始使用。
目前,煤气被用作热源。
石油
汽油和柴油是从一种称为石油的天然资源中获得的。
石油是由生活在海里的生物形成的。
数百万年来(埋在地球内部的死亡生物),在高温、高压和无空气的条件下,死亡生物转化为石油和天然气。
1859年,世界上第一口油井在美国宾夕法尼亚州钻探成功。
1867年,在印度阿萨姆邦的马库姆发现了石油。
在印度,石油主要产于阿萨姆邦、古吉拉特邦、孟买高地、马哈拉施特拉邦以及戈达瓦里河和克里希纳河的流域。
下图说明了气体和石油的层状分布:
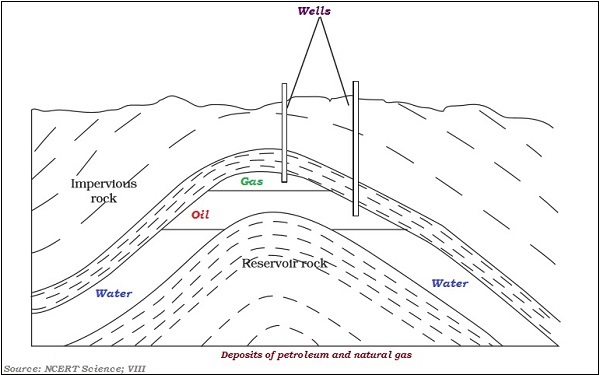
石油是由各种成分组成的混合物,例如汽油、石油气、柴油、润滑油、石蜡等。
分离石油各种成分的过程称为精炼。
从石油和天然气中获得的不同有用物质被称为“石化产品”。
石化产品用于制造洗涤剂、纤维(涤纶、尼龙、丙烯酸等)、聚乙烯和其他人工塑料。
从天然气中获得的氢气用于生产化肥(尿素)。
由于具有巨大的商业价值,石油也被称为“黑色黄金”。
天然气通常在高压下储存,因此被称为压缩天然气 (CNG)。
CNG 用于发电和作为车辆燃料。
下表列出了石油的各种成分及其用途:
| 石油成分 | 用途 |
|---|---|
| 液态石油气 (LPG) | 家庭和工业燃料 |
| 汽油 | 汽车燃料、航空燃料、干洗溶剂 |
| 柴油 | 重型汽车燃料、发电机燃料 |
| 煤油 | 炉灶燃料、灯油和喷气式飞机燃料 |
| 润滑油 | 润滑 |
| 石蜡 | 药膏、蜡烛、凡士林等。 |
| 沥青 | 油漆、路面铺设 |
化学——燃烧和火焰
引言
一种物质与氧气反应并放出热的化学过程称为燃烧。
进行燃烧的物质称为可燃物或燃料。
燃料可以是固体、液体或气体。
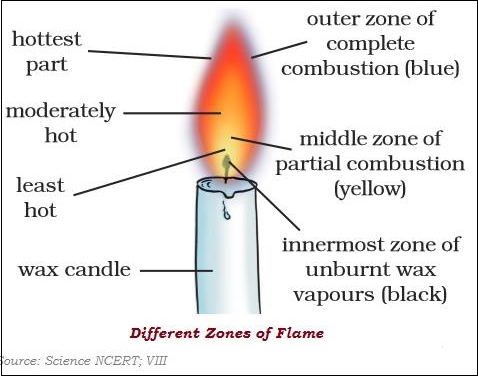
在燃烧过程中,光也会以火焰或辉光的形式释放出来。

在燃烧过程中汽化的物质会产生火焰。
火焰有三个不同的区域:暗区、明亮区和非明亮区。
不同物质的着火温度不同。
物质着火的最低温度称为其着火点。
火柴含有三硫化锑和氯酸钾。
火柴的摩擦面含有玻璃粉和少量红磷。
红磷危险性小得多。
当火柴棒摩擦摩擦面时,一些红磷转化为白磷;该过程立即与火柴头中的氯酸钾反应,产生足够的热量来点燃三硫化锑;以此类推,燃烧开始。
着火点非常低,很容易着火的物质称为易燃物质。例如汽油、酒精、液化石油气(LPG)等。
灭火器
水是最常见的灭火器。
水作为灭火器,仅当木材和纸张着火时才有效。

如果电器着火,水可能会导电并损坏试图灭火的人。
水也不是扑灭涉及油和汽油的火灾的好灭火剂。
对于涉及电器和易燃材料(如汽油)的火灾,二氧化碳(CO2)是最好的灭火剂。

获得CO2的方法之一是释放大量诸如碳酸氢钠(小苏打)或碳酸氢钾之类的化学干粉。
磷在室温下在空气中燃烧。
1公斤燃料完全燃烧产生的热能称为其热值。
燃料的热值以千焦每公斤(kJ/kg)为单位。
下表列出了不同燃料的热值:
| 燃料 | 热值 (kJ/kg) |
|---|---|
| 牛粪饼 | 6000-8000 |
| 木材 | 17000-22000 |
| 煤 | 25000-33000 |
| 汽油 | 45000 |
| 煤油 | 45000 |
| 柴油 | 45000 |
| 甲烷 | 50000 |
| 压缩天然气 (CNG) | 50000 |
| 液化石油气 (LPG) | 55000 |
| 沼气 | 35000-40000 |
| 氢气 | 150000 |
大多数燃料的燃烧会向环境中释放二氧化碳。
空气中二氧化碳浓度的增加很可能是造成全球变暖的原因。
地球大气温度的上升称为全球变暖。
全球变暖导致极地冰川融化,从而导致海平面上升,最终导致沿海地区发生洪水。
硫和氮的氧化物溶于雨水中形成酸;这种类型的雨水称为酸雨。