σ键和π键的区别
引言
在化学领域,研究化学键既至关重要又引人入胜。实际上,化学键是一种力,它在原子相互作用时将原子结合在一起。化学键也可以分为多种类型,包括离子键、共价键、极性键和氢键。除了上述键之外,还有许多其他类型的键。在本节中,我们将详细介绍称为σ键和π键的共价键。共价键在化学物质的存在中起着至关重要的作用。本文还将有助于清楚地理解σ键和π键之间的区别。
σ键和π键介绍
σ键和π键可以通过原子轨道的重叠来区分。当原子轨道发生重叠时,就会形成共价键。σ键是在原子轨道头对头重叠时形成的,而π键是在两个原子轨道并排重叠时形成的。σ和π分别源于希腊字母。
原子轨道的重叠会影响键角、键长和键焓。这种重叠导致两种不同类型的共价键,即σ键和π键,它们以两种不同的方式发生。σ键通常比π键更强。在分子轨道理论中,两者都被大量用于预测分子的行为。
什么是σ键?
当杂化轨道沿键轴相互重叠时,就会形成σ键。σ键中两个原子的共享电子密度正好位于键轴上。由此产生的键非常强且稳定。σ键是两个不同原子相互作用时首先形成的共价键。
由于能量较低,这些键更稳定。不存在键共振和超共轭。在这些键中,两个具有局域键的原子通过电子对连接。因此,σ键比普通键更强。一个简单的路易斯结构就可以完全构建具有目标σ键的化合物。此外,很容易预测它们的许多性质,包括键长、键能和偶极矩。
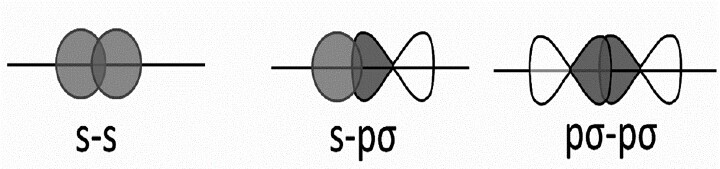
s-s重叠
这里,两个半充满的s轨道之间发生相互作用的位点是核间轴,如下图所示。
p-p重叠
相互靠近的两个原子具有半充满的p轨道,它们以这种方式重叠。
s-p重叠
这种类型的重叠发生在一个原子的半充满s轨道和另一个原子的半充满p轨道之间。
性质
杂化轨道相互堆叠形成σ键。
σ键坚固可靠。
在σ键的形成过程中,两个分子或原子相互作用的第一个过程。
σ键通常用符号𝜎表示。
所有烷烃、烯烃和炔烃都表现出σ键的形成。
什么是π键?
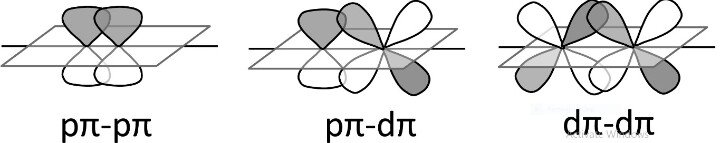
要形成π键,原子轨道必须以垂直于核间轴方向的侧向正(同相)方向连接。尽管重叠垂直于核间轴,但在键形成过程中,原子轨道轴彼此平行。
在π键形成过程中,原子轨道会收敛,使得它们的轴看起来垂直于中心轴并且彼此平行。构成侧向重叠轨道的两种碟形带电荷云位于参与原子的表面上方和下方。
这种键是由两个轨道的侧面或平行重叠形成的,例如py-py或pz-pz轨道。
性质
键轴上方和下方的杂化轨道相互重叠形成π键。
π键不稳定且较弱。
在σ键形成之后,π键形成。
π键的符号通常写为π。
π键不会在烷烃(饱和分子)中形成。π键形成发生在烯烃和炔烃等不饱和物质中。
σ键和π键的区别
| 参数 | σ键 | π键 |
|---|---|---|
| 轨道重叠 | 两个杂化轨道的头对头重叠形成σ键 | 并排重叠的杂化轨道形成π键 |
| 符号 | 用Σ表示 | 用π表示 |
| 键的形成 | 在其形成过程中,重叠轨道既可以是单个纯轨道,也可以是单个杂化轨道。此外,它还可以是两个纯轨道和两个杂化轨道。 | 在其键的形成中,重叠轨道应是两个未杂化的轨道。 |
| 形成顺序 | 这些键在原子相互作用时首先形成。 | 这些键是在σ键已经形成后在两个原子之间形成的。 |
| 反应性 | σ键合原子反应性很高。 | 原子上的π键不如σ键具有相同的反应活性。 |
| 存在和旋转 | 独立存在并可以自由旋转 | 始终需要σ键才能存在,并且旋转受到限制 |
| 强度 | 最强的键 | 与其他键相比较弱 |
| 对称性 | 围绕键轴,这些具有圆柱形电荷对称性。 | π键没有任何对称性。 |
| 分子结构 | σ键有助于确定分子形状。 | π键无助于确定分子的形状。 |
结论
总之,由于两个原子轨道的重叠,形成了两种不同类型的键,即σ键和π键。当两个原子轨道沿其轴线而不是侧向重叠时,或者当两个原子重叠时,就会形成σ键。这是σ键和π键之间的主要区别。π键比σ键弱,σ键总是先形成。单键总是σ键,而双键和三键分别还包含一个π键和两个π键。
常见问题
1. 为什么σ键不形成共轭体系?
由于所有共轭体系中都存在交替的单键、双键或三键,因此σ键不能形成共轭体系。
2. 为什么π键不如σ键强?
由于原子之间电子密度较低,π键通常比σ键弱,并且在MO图中具有更高的能量。
3. π键可以容纳多少电子?
构成三键的两个π键具有相同的性质。始终记住,π键只能容纳两个电子,这包括上平面和下平面。
4. 为什么π键不能单独形成?
键的键轴充当其对称平面。它需要至少形成p轨道;它不能由s轨道形成。90% 以上讨论过的键都以某种方式涉及碳、氮或氧。
5. 为什么更容易断裂π键?
π键的电子离原子核更远。由于原子核对电子的亲和力较弱,因此更容易断裂π键。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL JavaScript
JavaScript PHP
PHP