形式电荷及其性质
引言
形式电荷定义为赋予分子中一个原子上的电荷,假设所有化学键中的电子在原子之间平均分配,而不管相对电负性如何。或者,形式电荷也可以定义为原子在中性自由态下的价电子数与其在路易斯结构中所具有的电子数之间的差。形式电荷的公式为 − F=V-L-B/2,形式电荷是一个理论概念,它并不表示分子中任何真实的电荷分离。
什么是形式电荷?
形式电荷用F.C.或q表示,是在考虑所有化学键中的电子在原子之间平均分配,而不管相关电负性如何的情况下,赋予分子中一个原子的电荷。简单地说,我们可以将形式电荷定义为原子在中性自由态下的价电子数与其在路易斯结构中所赋予的电子数之间的差。当我们需要确定分子的最佳路易斯结构时,选择的结构应使各个原子上的形式电荷尽可能接近于0。形式电荷可以被认为是确定分子内电荷分布的一种工具。
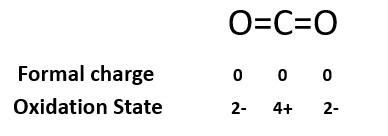
公式
分子中任何单个原子的形式电荷(q)可以通过以下公式给出:
$$\mathrm{F=V-L-B/2, }$$
其中,F=形式电荷(q),V=孤立中性原子价电子数,L=原子在分子中未成键价电子数,B=原子在分子中与其他原子共享的电子总数。
计算
我们知道形式电荷(q)=[原子上的价电子数]-[非键合电子数+键数]。
让我们计算BH4中B的形式电荷,硼(B)的价电子数为+3,非键合电子数为零(0),硼(B)周围的键数为4。因此,形式电荷(q) = 3-(0+4) = 3 - 4 = -1。
让我们计算:CH3中C的形式电荷,碳(C)的价电子数为+4,非键合电子数为0,碳(C)周围的键数为3。因此,形式电荷(q) = 4 - (0+3) = 4 - 3= +1。
重要性
形式电荷的一些重要性如下:
形式电荷(q)是一个理论概念,因此它不涉及或指示分子中任何真实的电荷(q)分离。
形式电荷在确定给定分子几种可能的路易斯结构中能量最低的构型方面也起着至关重要的作用。
此外,了解最低能量结构对于指出反应的主要产物至关重要。
能量最低的结构通常是形式电荷最小且实际电荷分布最广的结构。
示例
让我们以计算形式电荷为例。
1. 计算下列物质的形式电荷:
O3中的O原子
HClO4-离子中的Cl原子
F (形式电荷)=V(价电子)-L(非键合电子)-B(总电子数)/2
O1的形式电荷:6-2-6/2=+1。
O2的形式电荷:6-4-4/2=0。
O3的形式电荷:6-6-2/2=-1。
HClO4-离子中Cl原子的形式电荷:7-0-8/2=+3。
意义
分子中的一个原子必须具有零形式电荷才能具有最低能量,因此处于最稳定的状态。
我们知道形式电荷(q)用于指示分子的首选结构(s),但是当存在许多同样优选的结构时,问题变得更加困难。这是共振结构的情况。
分子的形式电荷(q)可以很容易地表明它在过程中将如何作用或表现。负形式电荷(-ve)表明该原子(a)更有可能成为反应中电子的来源(s)。
关于形式电荷的趣味事实
根据一些约定,形式电荷(q)对于描绘有机化学中完整正确的路易斯-凯库勒结构很重要,但对于无机化学则不适用。
具有最低电荷量的分子的结构变化是最优越的。
结论
形式电荷,用q表示,定义为赋予分子中一个原子的电荷,假设所有化学键中的电子在原子之间平均分配,而不管相关电负性如何。或者,形式电荷也可以定义为原子在中性自由态下的价电子数与其在路易斯结构中所赋予的电子数之间的差。形式电荷(q)的公式为- F=V-L-B/2。它也用于从所有可能的结构中选择能量最低的结构。
常见问题
1. 定义电负性。
电负性定义为化学元素原子在形成化学键时吸引共享电子的能力。
2. 中性态是什么意思?
当物体或材料既不带正电也不带负电时,它就被认为处于中性状态。
3. 描述路易斯结构。
路易斯结构,也称为路易斯点结构或电子点结构,是显示分子原子之间键合以及分子中可能存在的孤对电子的图示。
4. 计算形式电荷的公式。
形式电荷(q)的公式为- F=V-L-B/2。
5. 形式电荷用于什么?
形式电荷可以被认为是确定分子内电荷分布的工具。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP