凝固点降低
简介
当向溶剂中引入溶质时,就会发生凝固点降低现象,导致溶剂的凝固温度降低。
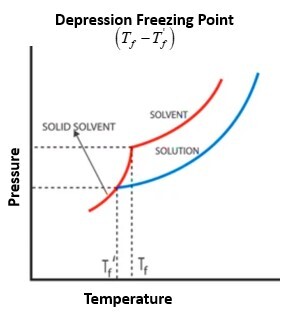
化合物的凝固点是指化合物在液相时的蒸气压等于其在固相时的蒸气压的温度。当非挥发性溶质分散在纯溶剂中时,根据拉乌尔定律,蒸气压会降低。因此,溶液的总蒸气压将低于纯溶剂的蒸气压。例如,水的凝固点为 0℃。此外,当溶质的摩尔浓度增加时,溶剂的凝固值会降低。
凝固点降低的定义
如果一种物质开始凝固,由于温度降低,分子会变慢,但分子间力开始起作用。分子也会按顺序排列并结晶。可以用蒸气压来说明凝固点降低。当溶质与溶剂混合时,溶剂分子会分散,由于拉乌尔定律,导致蒸气压降低。即使溶液的固相和液相的蒸气压在凝固点应该相同才能保持平衡,但蒸气压的显著降低会导致温度降低,从而使溶液的液相和冷冻形式的蒸气压相等。可以使用以下公式计算凝固点降低
$$\mathrm{\vartriangle\:T_{f}\:=\:i\:\times\:K_{f}\:\times\:molality}$$
其中,𝛥𝑇𝑓 = 凝固点降低
𝐾𝑓 = 凝固点降低常数
i = 范特霍夫因子
范特霍夫因子补偿了分解溶质在溶液中释放的粒子数量,而𝐾𝑓随溶剂而变化。
凝固点示例
当我们在结冰的路面上撒盐时,它会与少量水结合,防止冰重新结冰。
此特性可用于制作冰淇淋。
主要是在乳制品行业,我们利用凝固点降低来估计添加到牛奶中的水的精确数量;例如,EPD 大于 0.509°C 的牛奶被认为是纯牛奶。
由于此特性,伏特加等酒精饮料不会在冰箱中结冰。
该系统有助于车辆中使用的散热器液,防止水在寒冷地区结冰。
该方法使用乙二醇和水。
生活在寒冷地区的动物体内有天然的防冻化合物,如甘油和山梨醇。
此特性有助于降低它们体内水的凝固点,使它们能够生存。
由于凝固点降低很大,即使温度降至 0°C 以下,海水也不会结冰。
凝固点降低的用途
凝固点降低方程用于确定标准溶液中粒子的摩尔质量。
这可以用来计算某种溶质在溶剂中分散的标准。
在凝固点降低中,一种称为“低温学”的研究经常有用。“低温”在此处表示寒冷,“学”表示观察寒冷。它依赖于正确计算凝固点。
它可以用作差示扫描量热法等热分析方法中的一种纯度分析工具。
最值得注意的是,凝固点降低表明向溶液中添加溶质会降低其凝固点。
无论溶质和溶剂是液体、固体还是气体,凝固点都会降低。在固-固组合中也是可能的。
通过将拉乌尔定律与克劳修斯-克拉佩龙方程结合,该方程中使用的表达式称为布拉格登定律。
关于凝固点降低的趣味事实
各种在寒冷天气中生存的生物利用凝固点降低的概念来产生高浓度的各种化学物质。有一些物种产生防冻物质的例子,例如虹鳟鱼,这是一种生活在北极的鱼,它会产生甘油和相关分子,以便在冬季结冰的水道中生存。
其他物种,如春季雨蛙,在冬季相对较低的温度下会暂时提高其体液的摩尔浓度。同时,寒冷的天气会导致肝脏储存的糖原大规模分解,导致大量葡萄糖释放到循环系统中。
这些化学物质的产生有助于降低它们体内水的凝固点。据科学家称,随着压力的升高,凝固点也会升高。当过冷液体达到凝固温度时,会释放出熔化热。这会立即将温度升高到凝固点。
结论
在凝固点降低期间,物质的液相和固相具有相同的蒸气压。溶液的凝固温度低于纯溶剂的凝固温度。为了凝固,必须将溶液降低到低于其纯溶剂之一的温度。
溶液凝固点的降低是一种依数性。它由溶液中溶质分子的数量决定。因此,溶液中离子的数量越多,凝固点降低的程度就越大。克劳修斯-克拉佩龙方程和拉乌尔定律可用于计算凝固点降低。凝固点降低有许多有趣的和实际的用途。
常见问题
1. 𝜟𝑻𝒇 可能为负值吗?
凝固点降低定义为凝固点随溶质浓度的变化而变化。凝固点的变化表示为 $\mathrm{\vartriangle\:T_{f}\:=\:T_{f,solvent}\:-\:T_{f,solvent}}$。即使溶液的温度可能低于纯溶剂的温度,𝛥𝑇𝑓 也会为负值。
2. 为什么随着污染物的增加,水的凝固点降低?
由于溶液的浓度随着污染物的存在而增加,因此溶液的蒸气压降低。因此,冰在较低的温度下会更快融化。
3. 哪个温度最低?
虽然它不会开始分解以增加粒子的数量,但 1M 葡萄糖溶液似乎具有最高的凝固点。
4. 谁最先发现凝固点降低?
拉乌尔于 1867 年开始在格勒诺布尔大学任教,并一直担任教授直至 1870 年去世。他大约在 1886 年发现,水溶液的凝固点与其所含非电解质成分的数量成比例地降低。
5. 如何通过凝固点降低确定纯度?
当确定 𝐾𝑓 时,可以根据观察到的凝固点降低计算溶质的摩尔浓度,前提是浓度足够稀,可以被称为理想溶液。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 编程
C 编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP