氢气的制备及其多种用途
引言
氢气的制备在实验室和商业规模上都涉及多个步骤。氢是宇宙中最丰富的元素,用途广泛。
什么是氢气?
氢气在宇宙中含量丰富,是重量最轻的元素。它是一种气态、非活性元素,无色、无味、无臭且无毒。氢主要存在于水中或任何有机化合物中,也存在于动植物组织中。其独特的特性使其广泛应用于燃料、淀粉、酸和许多其他物质中。
氢气的性质
以下是氢气的性质:
物理性质:氢气无色、无味、无臭。它是一种易燃气体,但不助燃。氢的原子质量为1.008原子质量单位 (amu)。
化学性质:氢分子仅含一个H-H键,具有最高的键能。它与其他元素共享电子并形成共价键。由于键能高,氢在标准温度下反应性较低。因此,氢气的制备通常在电弧高温或紫外线照射下进行。
氢气的制备
氢气的制备涉及以下步骤:
实验室制备方法
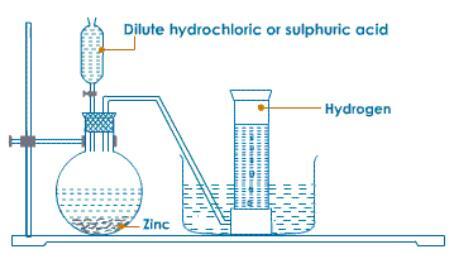
图1 - 实验室制备方法
在实验室中,可以使用粒状锌和稀盐酸制备氢气。也可以通过使过量的碱性水溶液与锌反应来制备氢气。反应方程式如下:
$$\mathrm{Zn\:+\:2NaOH\:\rightarrow\:\:+\:H_{2}}$$
工业制备方法
工业上制备氢气的方法有以下几种:
使用铂电极电解酸化水,可以产生氢气。
使用镍电极电解温热的氢氧化钡水溶液,可以得到高纯度的氢气。
在催化剂存在下,高温下水蒸气与烃反应可以产生氢气。

图2 - 电解法工业制备方法
烃类可用于生产合成气(也称为水煤气),水煤气由一氧化碳和氢气组成。合成气存在于污水、废料和其他相关物质中。它也可以通过煤气化技术从煤中提取。使用铁铬酸盐等催化剂在加热条件下,可以从烃类中提高氢气的产量。合成反应方程式如下:
$$\mathrm{CH_{4}(g)\:+\:H_{2}O(g)\:\rightarrow\:CO(g)\:+\:3H_{2}(g)}$$
$$\mathrm{CO(g)\:+\:H_{2}O(g)\:\rightarrow\:CO_{2}(g)\:+\:H_{2}(g)}$$
氢气的主要生产方法是使用烃类,少量则通过电解法生产。
其他方法
另一种制备氢气的方法是催化水蒸气-烃类法。将气态烃类在高压下与水蒸气一起在镍催化剂上处理,以产生一氧化碳和氢气。反应如下:
$$\mathrm{C_{n}H_{2n\:+\:2\:+\:nH_{2}O\:\rightarrow\:nCO\:+\:(2n\:+\:1)H_{2}}$$
$$\mathrm{C_{n}H_{2n\:+\:2}\:+\:2nH_{2}O\rightarrow\:nCO_{2}\:+\:(3n\:+\:1)H_{2}}$$
另一个重要的氢气生产过程是烃类在高压下的非催化部分氧化。
$$\mathrm{C_{n}H_{2n\:+\:2}\:+\:(n/2)O_{2}\:\rightarrow\:nCO\:+\:(n\:+\:1)H_{2}}$$
氢气的用途
以下是氢气的用途:
用于合成氨,制造氮肥和硝酸。
用于制造植物油和不饱和人造黄油。
用于制造许多有机物质,特别是甲醇。
氢气可用于生产氯化氢,这是一种有用的化学物质。
也用于制造金属混合物。
氢气在冶金过程中有助于将金属氧化物还原为金属。氢气也可作为火箭燃料。
氢燃料电池也用于发电。与其他能源相比,它对环境没有任何负面影响,这是一个优势。
氧氢焰和原子氢焰也用于焊接铁和钢材料。
汽车工业正在进行大量关于使用氢燃料电池的实验。
结论
氢气是一种重要且独特的元素,用途广泛。它在电子构型、物理和化学性质方面与碱金属和卤素相似。氢也存在于太阳和恒星的组成中。尽管这种元素的生产存在局限性,但在自然界中它仍然非常丰富。
常见问题
1. 氢气的用途是什么?
氢气是最重要的元素之一,可用作燃料电池、动力车辆和工业中的燃料发电。
2. 为什么我们需要了解氢气的制备?
了解氢气的制备对于生命的存在以及许多其他用途都是必要的。它就像我们日常生活中大多数组成部分一样重要。
3. 氢气的化学名称是什么?
化学名称为氢气,分子式为H2。原子符号为H,原子序数为1。
4. 氢气是易燃气体吗?
氢气本身不易燃,但它助燃。有时点火会引发火灾。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP