磷化氢的制备、性质和用途
简介
磷化氢在实验室中通过使用白磷、氢氧化钠并在二氧化碳的惰性环境中加热来制备。磷化氢自然存在于人体的尿液、血液和唾液中。它在工业上有几种应用,但也存在一些健康危害。
关于磷化氢的信息
磷化氢被认为是一种有毒且易燃的元素,法国化学家通过在碳酸钾水溶液存在下加热磷 (P4) 发现了磷化氢。该实验产生了具有鱼腥味的无色气体。磷化氢被认为是生物化学生命周期中的一种重要元素。由于该化合物在大气中的浓度,该元素的化学性质非常不稳定。
磷化氢的结构
PH3 的结构几何形状为三角锥形。磷化氢的路易斯点结构包含一对孤电子对。磷原子的另外三个电子与三个氢原子共享,形成 PH3 分子的共价键。
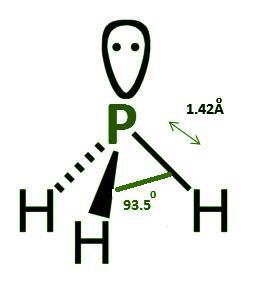
图 1 - 磷化氢结构
此外,以下是磷化氢分子的重要事实:
磷和氮元素都位于元素周期表中的 15 族。PH3 的分子结构与 NH3(氨)相同。
磷的电负性低于氮。
磷化氢结构中 H-P-H 的键角为 95.3°。
P-H 的键长为 1.42 Å。
磷化氢的制备
磷化氢的制备分几个步骤进行,具体步骤如下:
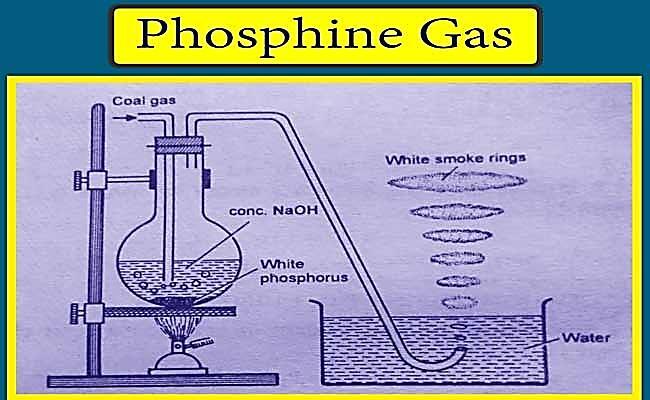
图 2 - 磷化氢气体的制备
金属磷化物的酸碱水解(例如磷化钙) - 金属磷化物与水或 HCl 溶液反应生成磷化氢。
由亚磷酸制备 - 亚磷酸 (H3PO3) 分解的过程可以通过纯形式的磷化氢来表示。
由磷制备 - 该生产过程从加热白磷开始,可以在 NaOH 溶液中生成 PH3,同时需要有 CO2 环境。
$$\mathrm{Ca_{3}P_{2}\:+\:6H_{2}O\:\rightarrow\:2PH_{3}\:+\:3Ca(OH)_{2}}$$
$$\mathrm{4H_{3}PO_{3}\:\rightarrow\:3H_{3}PO_{4}\:+\:PH_{3}}$$
磷化氢生成后,需要进行纯化。P2H4 或 P4 的存在使磷化氢成为不易燃的气体。吸收 HI 的过程可以将其转化为 PH4I。因此,加入氢氧化钾可以得到纯净的磷化氢。
$$\mathrm{PH_{4}I\:+\:KOH\:\rightarrow\:PH_{3}\:+\:KI\:+\:H_{2}O}$$
磷化氢的性质
磷化氢的性质可以分为以下两种形式:
物理性质
气体的气味像腐烂的鱼。气体的沸点为 126°F,气体的熔点等于 208.8°F。此外,它“微溶于水”。
该气体的临界温度为 124.9°F。该气体的比重为 1.203。用 PH3 表示。在 70°F 的温度下,其液体密度为 35.50。
化学性质
根据与其他物质的反应,可以判断 PH3 的化学性质。当它与 HBr、HI 和 HCl 发生反应时,可以生成含有鏻离子的化合物。
$$\mathrm{PH_{3}\:+\:HBr\:\rightarrow\:PH_{4}Br}$$
$$\mathrm{PH_{3}\:+\:HI\:\rightarrow\:PH_{4}I}$$
$$\mathrm{PH_{3}\:+\:HCl\:\rightarrow\:PH_{4}Cl}$$
这种气体被认为是有毒气体。即使少量接触也会导致黄疸和头晕等副作用。由于炎症、恶心、脑痛和疲劳,肝脏和肾脏等器官会出现问题。
磷化氢的应用
以下是 PH3 在不同行业中的重要应用:
在半导体行业,它少量用作掺杂剂。
由于具有自燃的特性,它被用在霍姆斯信号中。
该气体的应用可以产生金属磷化物。
烟幕 - 磷化钙在水中吸收磷化氢时会产生烟幕,在一些冲突中,它被用来掩护士兵不被敌人发现。
结论
磷化氢被认为是一种无色气体,具有一些难闻的气味。它被用于各种工业应用。磷化氢被认为是有毒的。该气体本身并不易燃。但是,当与任何氧化性物质接触时,它会燃烧甚至爆炸。它可以在实验室中以各种应用进行制备。
常见问题
1. 称为磷化氢的气体的主要性质是什么?
磷化氢的主要性质是:无色、有毒、溶于水,并具有难闻的鱼腥味。
2. 磷化氢的结构是什么?
磷化氢的几何结构是三角双锥形,其中 P 原子上有一对电子,以及三个 P-H 键,键长为 1.42 Å。
3. 磷化氢气体如何在化学实验室中制备?
白磷在 CO2 的惰性气氛下用浓 NaOH 溶液加热,生成 PH3。


 数据结构
数据结构 网络
网络 关系型数据库管理系统
关系型数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP