氧气的制备、性质和用途
引言
氧气是一种氧化剂,能与大多数元素和其他化合物容易地形成氧化物。它是元素周期表中氧族元素的成员,是一种高反应性的非金属元素。在宇宙中,氧气的丰度仅次于氢和氦,是地球上最丰富的元素。目前,地球大气中约有20.95%是双原子氧气。地球地壳几乎一半是由氧化物(氧的化合物)组成的。氧的原子序数为8,元素符号为O。

什么是双原子氧?
双原子氧(O₂)是元素氧最常见的同素异形体之一,其分子中包含两个氧原子。它通常被称为氧气,但也称为双原子氧、分子氧或氧气,以区别于元素氧。臭氧(O₃)是已知的最强氧化剂之一,由于它不具有氯化水特有的味道,因此被用于净化饮用水。除了惰性气体外,几乎所有元素都与氧气发生反应。所得物质称为氧化物。氧气是燃烧所必需的,但它本身不可燃。氧气是维持哺乳动物生命所必需的,因为它有助于能量的释放,是一种生命之气。
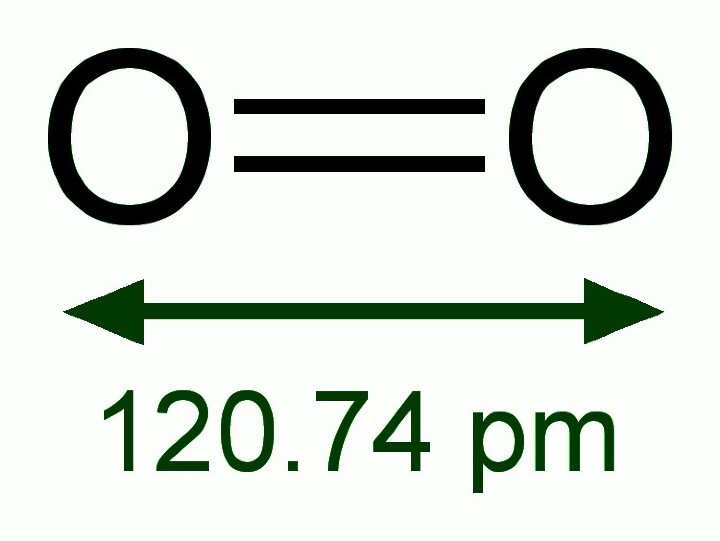
与14族和15族元素类似,16族中最轻的元素具有形成多重键的最大倾向。因此,元素氧在自然界中以O=O的双原子气体形式存在。
Explore our latest online courses and learn new skills at your own pace. Enroll and become a certified expert to boost your career.
实验室制备双原子氧
双原子氧可以通过多种方法在实验室中制备。
富氧盐如硝酸盐和高锰酸盐在热分解时会产生双原子氧。
氯酸钾在二氧化锰的催化作用下热分解产生双原子氧。
电化学系列中电极电位相对较低的金属氧化物,如氧化汞和氧化银,在热分解过程中也会产生双原子氧。
过氧化氢分解也会产生氧气,加入二氧化锰作为催化剂可以加快反应速度。
2KNO3→2KNO2+O2
2KMnO4→K2MnO4+MnO2+O2
2NaNO3→2NaNO2+O2
2KClO3→2KCl+3O2
2HgO(s)→2Hg(l)+O2
2PbO2(s)→2PbO(s)+O2(g)
2H2O2(aq)→2H2O(l)+O2(g)
工业制备
通过将洁净干燥的空气流通过沸石分子筛,也可以制备双原子氧。在N₂气体被吸收后,提供的90-93%的气体是氧气。
电解水也能制备氧气。在阴极释放氢气,在阳极释放氧气。
可以通过液态空气的分馏法分离氧气。首先去除水和二氧化碳。然后,氧气以液态形式留下,氮气(N₂)则以蒸汽形式蒸馏出来。
双原子氧的性质
物理性质
其分子量为31.99 g/mol。为了方便使用,采用32 g/mol的摩尔质量。
它在水中溶解度很高(在293K时,100cm³水中溶解3.08cm³)。
它是一种无色无味的氣體。
在-183°C时,它是浅蓝色的液体。
由于其密度为1.429 g/L,它比空气密度大。
其沸点为-182.962°C。
其熔点为-218.79°C。
它具有顺磁性。
化学性质
氧气是一种高反应性元素,能与几乎所有金属和非金属直接反应。一些金属,如金和铂,以及一些惰性气体,如氦、氩和氖,没有明显的反应。
因此,大多数金属和非金属都能与其直接反应,生成相应的元素氧化物。
其性质为顺磁性。
通常情况下,酸和碱不会使氧气发生反应。
氧气是一种有效的氧化剂,有助于燃烧。
氧气与潮湿作用会使铁生锈。
4Na+O2→2Na2O(与金属反应)
C+O2→CO2(与非金属反应)
燃料+O2→CO2+H2O
Fe+O2+H2O→Fe2O2.nH2O(水合氧化铁)
双原子氧的用途
双原子氧是呼吸所必需的。
它被用于液体火箭燃料。
它以氧乙炔的形式用于切割和焊接金属。
它可以用来生产硝酸。
医院和登山用的氧气瓶中含有它。
氧气和乙炔气体反应会产生氧乙炔火焰,用于切割和焊接金属。
氧气被用于净化水,包括废水处理和污水处理方法。
臭氧用于激光切割。
它与甲烷或二氧化碳一起用于人工呼吸。
氧气用于燃烧过程。将氧气与空气混合可以促进燃烧,因为通常不燃烧的物质在氧气中很容易燃烧。
结论
氧气是一种高反应性的气体,无色、无味、无嗅。在地球的地壳中,它并非以纯净的形式存在。由于其高电负性和反应活性,它与几乎所有金属和非金属形成氧化物。可以通过加热分解富氧物质如过氧化钡、氯酸钾、高锰酸钾、硝酸钾等来制备氧气。也可以通过过氧化物和水来获得氧气。双原子氧是可燃的和顺磁性的。存在氢键。
氧气是维持地球生命的重要组成部分。它是这个过程的核心。它用于水肺潜水、登山和医院填充人工呼吸器。氧气有广泛的工业应用。它对包括钢铁在内的多种金属的生产和焊接过程至关重要。
常见问题
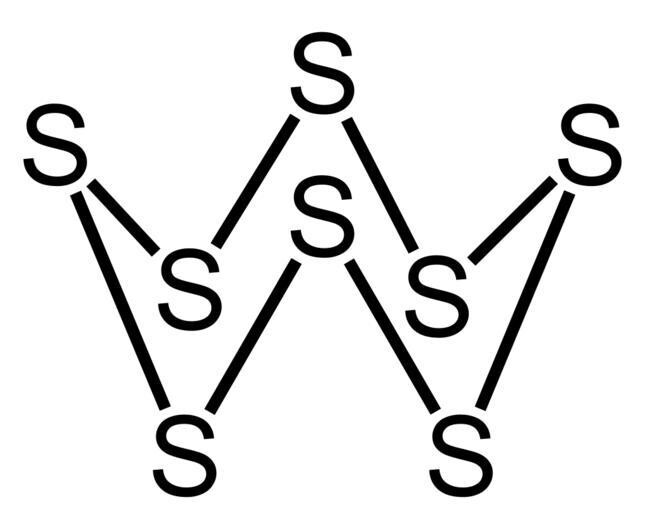
1. 为什么硫是固体而双原子氧是气体?
由于小氧原子中较强的电子间斥力,O-O键比S-S键弱。此外,由于氧的电负性更高且原子半径更小,它会形成p-p多重键。因此,它以氧分子存在,这些分子通过可忽略的范德华力结合在一起。在标准温度下,氧气是气体。硫比其他元素不太可能形成p-p多重键。它也形成强S-S单键,原子半径大,电负性低,这解释了其增强的链增长和以具有褶皱环状结构的S₈分子存在。因此,硫在室温下是固体。
2. 臭氧是如何形成的?
我们可以通过在冷、干、纯氧中静静地放电来制造臭氧,使用特殊的装置。这种装置通常被称为臭氧发生器。通过这种方法,我们可以生产浓度为10%的气体。
3. 碱金属与氧气反应会发生什么?
碱金属(I族元素)与氧气反应非常迅速。应将碱金属远离氧气以防止氧化。该族中最下面的金属比最上面的金属反应性强得多。较轻的碱金属生成超氧化物MO₂,而锂和钠分别生成一氧化物Li₂O和Na₂O。
4. 双原子氧是化合物还是分子?
它由两个通过共价键结合在一起的氧原子组成,因此它是一个双原子分子。
5. 双原子氧是一种蓝色的气体,对生命不重要。这是真的还是假的?
我们呼吸的氧气是双原子氧气。这是一种无色、无味、无嗅的气体。它对生命至关重要,因为植物和动物在代谢过程中使用它,代谢过程会燃烧食物成分以产生能量。因此,该说法是错误的。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP