碳酸钠标准溶液的制备
引言
Na2CO3溶液是用高纯度化学试剂配制而成,其精确浓度决定了标准化的程序。这种溶液指的是用其初步标准品配制成的精确已知浓度的溶液。一级标准物质必须含有更高纯度的化学元素、更高的水溶性以及较高的摩尔质量。
什么是碳酸钠?
Na2CO3在自然界中广泛分布。它在不同行业中有着许多重要的用途。该化合物也称为苏打灰,广泛应用于肥皂洗涤剂的生产过程中。
制备目的
本制备的主要目的是制备250 cm3 N/10的Na2CO3标准溶液。
制备所需材料
Na2CO3的制备过程需要一些必要的设备,例如:天平(用于称量化合物)、表面皿、砝码盒和250 mL烧杯。

图1 - 制备材料
制备过程中,还需要玻璃棒、约250 mL的量瓶、洗瓶以及称量试管。本制备还需要Na2CO3、漏斗、漏斗架以及一定量的蒸馏水。
理论
Na2CO3在NaOH标准溶液中主要不溶。当饱和NaOH溶液静置两天后,不溶的Na2CO3会沉淀在试管底部。小心地吸取上清液,即可制备出完全不含碳酸盐的稀NaOH溶液。
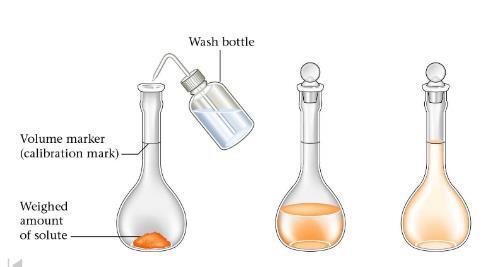
图2 - Na2CO3的制备过程
用于制备NaOH的蒸馏水必须煮沸,以除去任何溶解的二氧化碳,因为它会导致滴定过程中的误差。在制备Na2CO3标准溶液时,必须考虑其当量质量。对于100 mL溶液,需要1.325 g Na2CO3。
制备过程
Na2CO3溶液的制备过程按照正确的顺序进行,并精确地使用化学试剂。
首先,取一个表面皿,用蒸馏水清洗干净并彻底干燥。
然后称量干燥表面皿的精确质量,并记录下来。
之后,加入1.325 g Na2CO3,并记录下来。
借助漏斗,将化学试剂从干净的表面皿转移到量瓶中。
通过观察表面皿,可以看到化学试剂随蒸馏水一起转移,主要粘附在洗瓶的泡沫上。需要注意的是,体积不能超过50毫升。
然后用洗瓶用蒸馏水清洗漏斗,使盐全部通过漏斗。
应旋转烧瓶,直至化学试剂完全溶解。
然后,取洗瓶进行清洗,并将量瓶的刻度线稍微低于刻度线。
应逐滴加入剩余的蒸馏水,使弯月面液面达到刻度线。
最后,用塞子塞住烧瓶口,轻轻摇晃,使溶液混合均匀。这样,N/10 Na2CO3溶液的制备就完成了。
观察结果
在制备Na2CO3溶液的过程中,表面皿的实际质量为W1g(假设)。加入Na2CO3后表面皿的质量为W1 + 1.325 g。从制备过程中可以看出,化合物的质量为1.325 g,本制备中蒸馏水的实际体积为250 mL。
注意事项
如果在制备过程中不注意一些注意事项,溶液的制备过程有时可能会变得危险。这些注意事项如下:
称量化学试剂的时间是最危险的,因此在称量过程中应小心谨慎。
制备过程中应穿戴围裙。
制备的碱具有较高的腐蚀性,因此应小心处理。
本制备的表面皿必须干燥,漏斗应多次小心清洗。
如果操作不当,摇晃烧瓶中的溶液可能会很危险。
加入的弯月面液面不得超过量瓶上的刻度线。
结论
Na2CO3标准溶液的制备过程很简单,可以用一些特定的试剂制备。化学试剂的制备过程是通过特定的过程,并使用合适的设备来获得理想的结果。制备过程中也有一些风险因素,但可以通过小心谨慎和使用正确的技术来减轻。
常见问题
1. 摩尔浓度和质量摩尔浓度的区别是什么?
溶液的摩尔浓度是指每升溶液中存在的摩尔数。质量摩尔浓度是指每千克溶剂中存在的溶质摩尔数。
2. 什么叫酸碱滴定?
这是一种测定酸强度的方法。它用合适的指示剂滴定碱性标准溶液。
3. 什么叫酸的碱度?
酸的碱度是指被取代的氢原子数。这些原子存在于每个酸分子中。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP