阴离子系统分析
引言
系统地分析阴离子已成为富含定性性质的无机盐的组成部分。整个分析过程服务于两个目标之一:了解阴离子的种类和数量。
实验目的
本实验的目的是找出其阴离子形式中存在的总基团数。这种类型的基团在构成具有无机性质的盐的混合物中非常常见。
理论
阴离子的系统分析旨在找出并确认构成酸碱的不同类型的基团。由无机性质形成的盐包含碱性和酸性性质。酸性化合物具有一个体面的成分来定义它们的无机特性。由于存在“几何形状”,这种成分被称为“结晶固体”。这组特性已知携带一些被称为基团的电荷。盐分析有两个基本方面——其中一个是产物溶解度和共同离子效应。
实验步骤

图1 - 进行火焰测试
进行火焰测试,知识共享零,公共领域奉献,通过维基共享资源
| 序号 | 实验 | 观察 | 推论 |
|---|---|---|---|
| 1 | 初步操作 | 本实验中使用的盐未观察到明显的颜色。 | $\mathrm{Fe^{2+}\:,\:Fe^{3+}\:,\:Ni^{2+}\:and\:Co^{2+}}$ 离子在反应的第一阶段不存在。 |
| 元素的外观和其他物理性质。 | 这些盐的外观主要体现在颜色差异上。包括绿色、棕色、粉色和蓝色。 | 每种颜色的推论分别列出 - $\mathrm{Fe^{2+}\;,\:Ni^{2+}\:and\:Cu^{2+}}$. 棕色的推论是 Fe²⁺。如果盐是粉红色的,推论可能会有所不同,例如 $\mathrm{Co^{2+}\:and\:Mn^{2+}}$. 蓝色盐为 $\mathrm{Cu^{2+}}$。 | |
| 2 | 将观察元素中是否存在某些热量的作用。 | 观察到的热作用分为三种变化。该气体无色,具有强烈而刺鼻的气味,使红色石蕊试纸变蓝。石蕊试纸变蓝是因为有红棕色的蒸汽冒出。颜色随温度变化,冷时为白色,热时为黄色。 | 无色气体可产生 $\mathrm{NH_{4}^{+}}$ 盐。对于红棕色蒸汽,它们倾向于产生 $\mathrm{NO^{+}_{3}}$. 由于温度引起的变色表明存在 $\mathrm{(Zn)^{2+}}$. |
| 3 | 步骤的第三步称为火焰测试。在这个具体的测试中,少量浓盐酸可以使盐形成适当的糊状物。将糊状物放在本生灯火焰上。 | 该火焰测试的观察结果分为四个部分。第一个是火焰开始呈苹果绿色。第二个观察结果是火焰呈深红色。第三种颜色是砖红色,最后一种是蓝绿色。 | 推论分别表示为 $\mathrm{Ba^{2+}\:,\:Sr^{2+}\:,\:Ca^{2+}\:and\:Cu^{2+}}$ |
表1 - 实验步骤
观察结果
碳酸根阴离子 - 释放的气体是 $\mathrm{CO_{2}}$,具有非常强的泡腾现象。它们具有稀酸 $\mathrm{H_{2}SO_{4}}$,可以使石灰水变为乳白色。
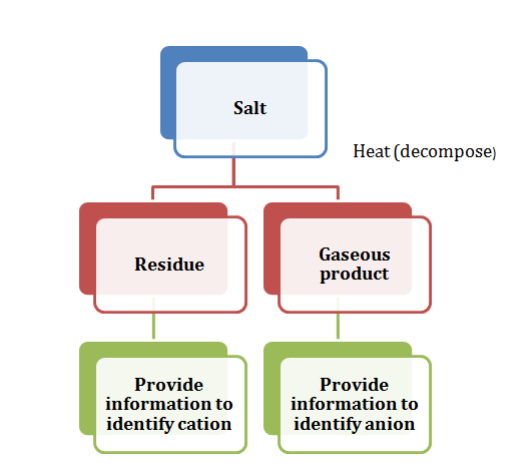
图2 - 干法测试
硫离子 - 在溶液中加入一滴硝普钠后,颜色会变成紫色或紫红色。
亚硫酸根阴离子 - 通过用氯化钡清除白色沉淀物来形成该阴离子的存在。当这种元素与稀盐酸反应时,溶液会消失。另一个观察结果是它开始释放二氧化硫气体。
注意事项
注意事项如下:
必须阅读标签以了解化学成分。
必须穿戴耐用织物制成的围裙。
在高级人员和同伴的严格监督下闻化学蒸汽。
化学物质决不能接触舌头。
切勿尝试在试管水中加入一滴酸。
切勿用裸手触摸试管,因为它们非常热。
务必戴上安全护目镜。
与化学物质和火保持安全距离,并应遵循预防措施。
结论
本教程解释了如何使用盐来查看所用阴离子的总量。该步骤展示了正确进行此实验的方法。由于某些离子的存在,无机盐具有不同的颜色。最后,本教程以必须为确保每个人的安全而采取的基本预防措施结束。
常见问题
1. 共同离子效应对无机化学领域有何意义?
共同离子效应对有机化学领域的重要性在于,它与弱酸或弱碱一起发挥作用,以防止其发生电离过程。
2. 阴离子的定性分析是什么意思?
阴离子的定性分析已知可以对给定化合物中发现的阴离子和阳离子的数量进行正确的计数。也可以对单个元素进行这种分析分解,以达到寻找该元素中存在的阴离子和阳离子正确数量的相同目标。
3. 以基团形式存在的阴离子总数是多少?
以基团形式存在的阴离子总数共有两个。其中一个是已知的 16 族,带 -2 电荷。另一个被称为 15 族,带 -3 电荷。


 数据结构
数据结构 网络
网络 关系数据库管理系统 (RDBMS)
关系数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP