赫斯定律
简介
赫斯定律是由俄罗斯化学家格尔曼·赫斯博士于1840年提出的,他在其中阐述了许多热化学原理。赫斯定律是热力学第一定律的结果,但由于其重要性而被单独列为一条定律。该定律涉及反应热的计算。
热力学第一定律指出,特定反应中的焓变等于反应过程中吸收或释放的能量。赫斯定律也处理化学反应的能量,它指出能量变化不依赖于反应途径或所涉及的步骤,而是能量变化始终为常数。
什么是赫斯定律?
赫斯定律指出,化学反应中涉及的焓变或能量变化与其途径或所涉及的步骤数无关。这意味着能量变化的值始终是恒定的。无论反应是经过3个步骤还是4个步骤,能量变化都将相同。赫斯定律允许计算伴随化学反应发生的焓变,其中能量变化未知。
焓值将取决于反应中涉及的分子数量,因为焓是一种广延性质。因此,焓变也将取决于化学反应中涉及的分子数量。因此,即使反应采取不同的途径或多个步骤,焓变也将相同。只需要知道初始状态和最终状态。
能量也以热量的形式存在。因此,在放热过程中,能量被释放。而在吸热过程中,能量被消耗。向前方向为放热的反应,在反向方向上必须是吸热的。通过这种方式,化学反应中的能量值是恒定的。
它也可以定义为任何化学过程的能量等于所有步骤的能量之和,即对于特定的化学反应,能量始终为常数。即总焓变,$\mathrm{\Delta\:H\:=\:\Delta\:H_{1}\:+\:\Delta\:H_{2}\:+\:\Delta\:H_{3}\:+\Delta\:H_{4}\:+\:\Delta\:H_{5}\:+\:\Delta\:H_{6}}$。它可以表示为:
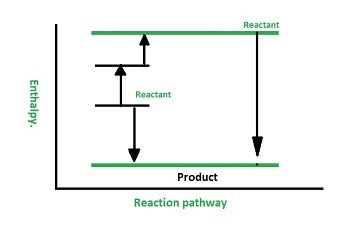
赫斯定律的示例
赫斯定律可以通过举例子来说明。氢气产生的化学过程为:
$$\mathrm{C(s)\:+\:2H_{2}O(g)\:\rightarrow\:CO_{2}(g)\:+\:2H_{2}(g)\:,\:\Delta\:H\:=\:90.1\:Kj}$$
此反应可以转换为不同的步骤,如下所示:
$$\mathrm{C(s)\:+\:O_{2}(g)\:\rightarrow\:CO_{2}(g),\Delta\:H\:=\:-393.5Kj}$$
$$\mathrm{2H_{2}(g)\:+\:O_{2}(g)\:\rightarrow\:2H_{2}O(g)\:,\:\Delta\:H\:=\:-483.6\:Kj}$$
但焓变是恒定的,$\mathrm{\Delta\:H\:=\:90.1\:Kj}$。这可以通过下图来说明。
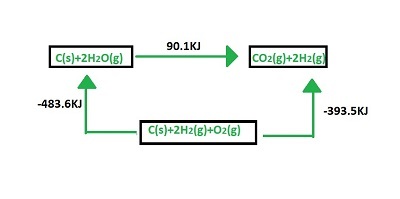
赫斯定律示例
涉及从硫生成三氧化硫气体的反应的焓变可以用赫斯定律来解释。
$$\mathrm{S\:+\:O_{2}\:\rightarrow\:SO_{2}\:,\:\Delta\:H_{1}\:=\:-70.96\:KCal/mol.}$$
$$\mathrm{SO_{2}\:+\:12O_{2}\:\rightarrow\:SO_{3}\:,\:\Delta\:H_{2}\:=\:-23.49KCal/mol}$$
$$\mathrm{\Delta\:H\:=\:\Delta\:H_{1}\:+\:\Delta\:H_{2}\:=\:-7096\:+\:-23.49\:=\:-94.95KCal/mol}$$
总反应中的焓变为:
$\mathrm{S\:+\:32O_{2}\:\rightarrow\:SO_{3}\:,\:where\:\:,\Delta\:H\:=\:-94.95KCal/mol}$
分步计算的焓变和净反应中的焓变相同。
赫斯定律的应用
它是计算许多化学反应能量的重要理论。它在化学领域有许多应用。其中一些应用包括:
焓变计算 - 它可用于计算化学反应中的焓变,其中焓变未知。并由此我们还可以预测反应是放热还是吸热。如果值为负,则为放热反应,如果为正,则为吸热反应。
生成焓的计算 - 可以借助赫斯定律计算未知的化学过程的生成焓。通过连续加减已知反应的焓值,我们可以很容易地1. 计算生成焓。例如,在由碳和氢构建苯的过程中,无法用常规方法计算生成焓。但是,借助赫斯定律可以计算这些不可测量的性质。
与物理变化相关的焓变 - 可以计算某些无法计算焓变值的反应,这将是一个假设值。例如,在石墨转化为金刚石的过程中,即使反应不可能发生,也可以计算焓变。
结论
赫斯定律是热力学中的一条重要定律。即使它是热力学第一定律的结果,但由于其特征重要性而被单独列为一条定律。根据该定律,无论采取多少步骤或反应完成的途径如何,焓变始终是恒定的。这是因为焓是一个状态函数。
赫斯定律有助于计算许多焓变未知的反应的总能量。生成焓也可以借助赫斯定律确定。另一个重要的应用是计算与物理变化相关的焓变。
常见问题
1. 赫斯定律在什么情况下不适用?
赫斯定律不能用于计算系统的熵。
2. 赫斯定律在现实生活中是如何应用的?
我们吃的食物通过一系列途径转化为能量。我们体内存在的碳水化合物转化为二氧化碳和水。赫斯定律指出能量变化始终是恒定的,这意味着当我们锻炼时会释放相同的能量,并被称为燃烧卡路里。所以,这是赫斯定律的应用。
3. 什么是熵?
熵是系统中随机性或无序程度的量度。熵将评估系统中可用于做功的单位温度下的热能量。
4. 哪种类型的反应总是自发的?
自发反应是指焓变∆H为负且熵变∆S为正的反应。遵循此条件的系统被称为自发反应。
5. 赫斯定律在汽车行业的应用是什么?
汽车行业的工作基于赫斯定律,因为它们更侧重于确定生产发动机所需的不同方法。借助该定律可以检查最有效的途径。例如,汽车公司检查汽油燃烧时发动机释放的能量。
6. 哪条热力学定律是赫斯定律的基础?
热力学第一定律是赫斯定律的基础。
7. “ΔE”是什么意思?
内能变化,也称为恒容热变化,用符号ΔE表示。


 数据结构
数据结构 网络
网络 关系数据库管理系统
关系数据库管理系统 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C 语言编程
C 语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP