气体动理论假设
介绍
在日常生活中,我们经常观察到光线透过小孔进入黑暗时空气分子的运动。气体动理论研究了空气分子的运动。借助动理论,可以根据气体存在的容器的压力(P)、体积(V)和温度(T)来定义气体的各种性质。微小粒子不会向上或向下移动,但它们可以向所有可能的方向移动。我们看不到这些粒子,因为它们的大小非常小,但我们能看到大粒子的运动。
Olivier Cleynen 和 User:Sharayanan,气体动理论 (2),CC BY-SA 3.0
什么是气体动理论?
气体包含大量大小可忽略不计的粒子,称为分子。这些分子处于持续或不断的运动状态,或处于随机运动状态。在这次随机运动中,分子不断地以一定的速度运动,并与容器或其所存放容器的壁发生碰撞。
这些碰撞是完全弹性的,几乎是瞬时的(持续时间很短),分子在碰撞之间以直线运动并获得均匀的速度。
假设
粒子总是持续地向所有方向随机移动,但其运动轨迹是直线。
粒子不受任何吸引力或排斥力的影响。
气体是由大量具有小质量的微小粒子(如原子或分子)组成的集合。
粒子之间的空间非常大,因为粒子彼此相距很远。因此,与容器的体积相比,粒子的体积可以忽略不计。
粒子总是处于不断的运动状态,因此它们具有动能,动能与温度成正比。
由于微小粒子之间或与容器的碰撞,碰撞是完全弹性的,不会改变粒子的动量或能量。当粒子与容器碰撞时,也会对容器施加压力。这个压力取决于单位面积上碰撞的粒子数量。
动能和压力
我们知道动量是质量和速度的乘积。
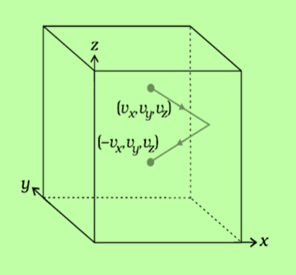
图2:分子在不同分量上的运动
分子动量的变化
$\mathrm{\Delta P=P_2-P_1}$
$\mathrm{\Delta P=mv_x-(-mv_x)}$
$\mathrm{P=2mv_x}$
连续碰撞的时间 $\mathrm{t=\frac{2A}{V_x}}$ 所以作用在壁上的力为
$\mathrm{F=\frac{\Delta P}{\Delta t}}$
$\mathrm{F=\frac{2mv_x}{2Av_x}}$
$\mathrm{F=m v_x^{2}}$
x方向上的压力,$\mathrm{P_x=\frac{F_x}{A}=\frac{m}{A^3}(v_x^{2})}$
同样,对于y方向 $\mathrm{P_y=\frac{m}{A^3}(v_y^{2})}$
以及对于z方向,$\mathrm{P_z=\frac{m}{A^3}(v_z^{2})}$
根据帕斯卡定律:
$\mathrm{P_x=P_y=P_z=P}$
我们可以写成,$\mathrm{P=\frac{P_x+P_y+P_z}{3}}$
现在代入所有方向的压力:
$\mathrm{P=\frac{m}{3A^3}(v_x^{2})+\frac{m}{3A^3}(v_y^{2})+\frac{m}{3A^3}(v_x^{2})}$
$\mathrm{P=\frac{m}{3A^3}(v_x^{2}+v_y^{2}+{v_z}^2)}$
$\mathrm{P=\frac{m}{3A^3}(v_{RMS}^2)}$
此外,我们可以写成,$\mathrm{P=\frac{1}{3}\rho (v_{RMS}^2).......(1)}$
其中 $\mathrm{v_{RMS}}$ - 均方根速度
$\mathrm{\rho}$ - 分子的密度
单位体积的动能:
$\mathrm{E=\frac{1}{2}\rho v^2...…(2)}$
将方程式 (1) 和 (2) 相除
$\mathrm{\frac{P}{E}=\frac{\frac{1}{3}\rho (v_{RMS}^2)}{\frac{1}{2} \rho v^2}=\frac{2}{3}}$
$\mathrm{P=\frac{2}{3}E}$
所以压力 $\mathrm{=\frac{2}{3}}$ 单位体积的动能
动能和温度
根据动理论
$\mathrm{P=\frac{1}{3}\rho (v_{RMS}^2)}$
$\mathrm{\rho=\frac{M}{v}}$
$\mathrm{P=\frac{1M}{3v}(v_{RMS}^2)}$
乘以并除以2
$\mathrm{PV=\frac{2}{3}\frac{1}{2}m(v_{RMS}^2)}$
$\mathrm{PV=\frac{2}{3}E}$
(我们知道 1 摩尔的理想气体方程 PV=RT)
$\mathrm{RT=\frac{2}{3}E}$
$\mathrm{E=\frac{3}{2}RT}$
每个分子的平均动能
$\mathrm{\overline{E}=\frac{E}{N}=\frac{3}{2}\frac{R}{N}T=\frac{3}{2}K_B T}$
N - 阿伏伽德罗常数
弛豫时间
这也被称为平均自由时间。粒子的运动是完全随机的。在它们的运动过程中,它们会发生碰撞并改变方向。每次碰撞都会使它们随机改变方向。
因此,在两次连续碰撞之间,两个粒子之间的平均时间或时间间隔称为弛豫时间。
平均自由程
在两次连续碰撞之间,分子以恒定速度沿直线路径运动。粒子相遇另一个粒子所走过的平均距离。并非每个路径长度或自由程都是相同的。它可能因不同的粒子而异。它用“λ”表示。
平均自由程:
$\mathrm{\lambda=\frac{1}{\sqrt{2}\pi d^2 \frac{N}{V}}(其中\:n=\frac{N}{V})}$
$\mathrm{\lambda=\frac{1}{\sqrt{2}\pi d^2 n}}$
其中 n 是单位体积内的分子数
d 是分子的直径
布朗运动
图片即将推出
图3:布朗运动
如果细小的粒子(原子或分子)悬浮(散布)在任何流体(液体或气体)中,它们就会开始向所有可能的方向进行随机运动,并彼此碰撞,并与它们所保持的容器碰撞,形成锯齿状路径。这种运动称为布朗运动。
植物学家罗伯特·布朗于 1827 年首次描述了这种运动,因此为了纪念他,这种运动被称为布朗运动,当时他用显微镜观察浸在液体中的花粉粒。
后来在 1905 年,爱因斯坦提出了他的布朗运动理论。花粉粒由于粒子的碰撞或轰击而随机移动。这就是爱因斯坦在他的论文中所展示的。让·佩兰证实了这一解释,并因此获得了 1926 年的诺贝尔奖。在阳光照射到布满灰尘的房间时,可以观察到一些现象。我们观察到灰尘粒子随机移动。
结论
气体动理论有助于理解粒子的宏观性质或微观性质。通过知道温度,我们可以很容易地找到平均动能,因为动能与温度成正比。所有这些都可以在原子理论中进行研究。气体动理论的结论是粒子总是在运动。
常见问题
Q1。均方根分子速度取决于哪些量?
答:我们知道,$\mathrm{v_{RMS}=\sqrt{\frac{3RT}{M}}}$
气体的速度是
与绝对温度成正比
与气体的摩尔质量成反比
此外,$\mathrm{摩尔质量=\frac{体积}{摩尔}}$
$\mathrm{摩尔质量=\frac{体积}{\frac{质量}{M}}}$
因此,摩尔体积与气体的均方根速度成正比。
Q2。一辆装有货物的卡车以均匀速度行驶。放在卡车上的罐装气体内部的气体分子温度是多少?
答:分子获得相对速度,均方根速度与横向平移不同。
Q3。气体分子平均动能取决于哪些因素?
答:气体原子或分子的平均动能取决于温度,因为动能与绝对温度成正比。
$\mathrm{K=\frac{3}{2}\frac{R}{N_A}T}$
Q4。如果氢气和氧气样品的体积相同,那么哪个样品的分子数量更多?
答:如果两个样品的体积相同,则气体的温度和压力相同。结果,两个样品的分子数量相同。
Q5。氢 (H) 分子的温度和均方根速度在 79°C 时等于氧 (O) 分子的温度和均方根速度。
答:我们知道:
$\mathrm{v_{RMS}=\sqrt{\frac{RT}{M}}}$
氧分子的均方根速度等于氢的均方根速度。
$\mathrm{\sqrt{\frac{273+79}{32}}=\sqrt{\frac{T}{2}}}$
$\mathrm{\frac{352}{32}=\frac{T}{2}}$
$\mathrm{11\:\times\:2=T}$
$\mathrm{T=22^{\circ}C}$
因此需要 22°C 的温度。


 数据结构
数据结构 网络
网络 关系型数据库管理系统 (RDBMS)
关系型数据库管理系统 (RDBMS) 操作系统
操作系统 Java
Java iOS
iOS HTML
HTML CSS
CSS Android
Android Python
Python C语言编程
C语言编程 C++
C++ C#
C# MongoDB
MongoDB MySQL
MySQL Javascript
Javascript PHP
PHP